
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下________(填“能”或“不能”)自发进行。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下________(填“能”或“不能”)自发进行。
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
该反应的正反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
【答案】不能 放 0.17 c d
【解析】
(1)该反应△H>0,△S>0,若使△G=△H-T△S<0,必须在高温下,所以常温下反应不能自发进行;
(2)该反应气体物质反应前后不变,等比例的投入,为等效平衡,若温度不变,转化率不变,现温度发生改变,可以通过转化率判断平衡移动。实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;
平衡时CO的物质的量为1.6mol,则列三段式有:
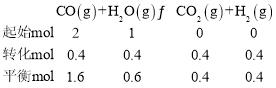
该反应前后气体系数之和相等,故可利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数K=![]() ;
;
(3)根据能量变化图可知该反应为放热反应,
a.升高温度可使平衡逆向移动,c(CH3OH)减小,故不符合;
b.该容器恒容,所以充入He(g),体系压强增大,但各物质的浓度不变,平衡不移动,故不符合;
c.将H2O(g)从体系中分离出来可使平衡右移,c(CH3OH)增大,故符合;
d.再充入1 mol CO2和3 mol H2,若达到等效平衡,则c(CH3OH)不变,但该容器为恒容密闭容器,相当于增大压强,且反应物气体系数之和大于生成物气体系数之和,所以平衡会正向移动,c(CH3OH)增大,故符合;
综上正确是cd。


科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。请回答以下问题:

(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,其中Be(OH)2显示这种性质的离子方程式是 __________________________、_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42﹣(黄色)+ 2H+ → Cr2O72﹣(橙红色)+ H2O Ba2+ + CrO42﹣ → BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b molL﹣1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,BaCl2溶液的浓度为_________________mol/L(含x、y的表达式),若步骤Ⅱ 中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扎来普隆是一种短期治疗失眠症的药物,其合成路线如下:
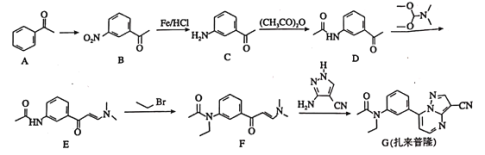
回答下列问题:
(1)A中的官能团名称是________________。
(2)![]() 所需的试剂和条件分别为________________。
所需的试剂和条件分别为________________。
(3)![]() 、
、![]() 的反应类型依次为________、________。
的反应类型依次为________、________。
(4)扎来普隆的分子式为________________。
(5)![]() 的化学方程式为________________________。
的化学方程式为________________________。
(6)属于芳香化合物,且含有硝基,并能发生银镜反应的B的同分异构体有________种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式有________________。
(7)已知:![]() 有碱性且易被氧化。设计由
有碱性且易被氧化。设计由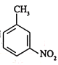 和乙醇制备
和乙醇制备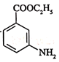 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO+Br2→CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3·H2O+H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应L(s)+G(g)![]() 3R(g) (正反应为吸热反应),下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g) (正反应为吸热反应),下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
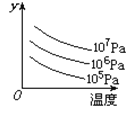
A.平衡混合气中R的质量分数B.达到平衡时G的转化率
C.平衡混合气中G的质量分数D.达到平衡时L的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使高锰酸钾酸性溶液褪色
②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能还原成环己烷
④苯中碳碳键的键长完全相等
⑤邻二氯苯只有一种
⑥间二氯苯只有一种
A. ①② B. ①⑤
C. ③④⑤⑥ D. ①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com