
����Ŀ������(Ni-Cd)�ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ������:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2�йظõ�ص�˵����ȷ����( )
Cd(OH)2+2Ni(OH)2�йظõ�ص�˵����ȷ����( )
A.���ʱ������Ӧ��Cd(OH)2+2e- = Cd+2OH-
B.����������������Һ�ļ�����ǿ
C.�ŵ�ʱ����ת��Ϊ��ѧ��
D.�ŵ�ʱ�������Һ������1molH2Oʱ��·��ͨ��2mol����
���𰸡�A
��������
�����ܷ�Ӧ���õ���зŵ�ʱ��������ӦʽΪCd-2e-+2OH-=Cd(OH)2�������Ϸ����ĵ缫��ӦʽΪ��NiOOH+e-+H2O�TNi(OH)2+OH-�����ʱ�����Ϸ����ĵ缫��ӦʽΪ��Ni(OH)2+OH--e-�TNiOOH+H2O�������Ϸ����ĵ缫��ӦʽΪ��Cd(OH)2+2e-�TCd+2OH-���ŵ�ʱ���������ƶ����������������ƶ����ݴ˷������
A�����ʱ�����õ��ӷ�����ԭ��Ӧ���缫����ʽΪ��Cd(OH)2+2e-�TCd+2OH-����A��ȷ��
B�����ʱ������ӦΪNi(OH)2+OH--e-=NiOOH+H2O�����������������Լ�������B����
C���ŵ�ʱΪԭ��أ�����ѧ��ת���ɵ��ܣ���C����
D�����ݵ���ܷ�ӦCd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2����֪����1molˮʱ����0.5molCd��0�۱�Ϊ+2�ۣ���ת�Ƶ���1mol����D����
Cd(OH)2+2Ni(OH)2����֪����1molˮʱ����0.5molCd��0�۱�Ϊ+2�ۣ���ת�Ƶ���1mol����D����
�ʴ�ΪA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��CH4��һ�������ºϳ����CO2+CH4![]() CH3COOH�����������գ�
CH3COOH�����������գ�
(1)��д��̼ԭ��������Ӳ�Ĺ����ʾʽ______
����(Ti)��22��Ԫ�أ�����______(ѡ����)
a.����Ԫ�� b.����Ԫ�� c.������Ԫ�� d.������Ԫ��
(2)CS2���ӵĵ���ʽΪ______�����۷е��CO2�ߣ�ԭ����______�����£���1L pH=10�� NaOH��Һ�г���ͨ��CO2��ͨ��CO2�����(V)����Һ��ˮ���������OH������Ũ��(c)�Ĺ�ϵ��ͼ��ʾ
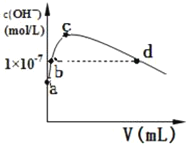
(3)c����Һ������Ũ���ɴ���С�Ĺ�ϵ�ǣ�______
(4)a����Һ����ˮ���������c(H+)=______��b����Һ��c(H+)______1��10��7mol/L(��д����������������������С����)
(5)��ʹ0.1mol/L������Һ�ĵ���̶��Լ�pH���������______(ѡ�����)
a.��ˮϡ�� b.�������������ƹ��� c.ͨ�Ȼ��� d.�������������ƹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��B �� C���������У���A��B ��X����X �� C�������仯��ͼ��ʾ��E1��E2��E3������0���������й�������ȷ����

A.��ӦA��B��C����ЧӦΪ (E3 - E1) kJ
B.��ӦX��CΪ���ȷ�Ӧ
C.X�Ƿ�ӦA��B��C�Ĵ���
D.��Ӧ A��B��X����ЧӦΪ - (E1 - E2) kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�����й�������ȷ����( )
A.������ȼ����Ϊ285.8kJ��mol-1����ˮ�ֽ���Ȼ�ѧ����ʽΪ2H2O(l)��2H2(g)+O2(g) ��H =+571.6kJ��mol-1
B.��֪2C(ʯī��s)+O2(g)��2CO(g) ��H =+221kJ��mol-1����ʯī��ȼ����110.5kJ��mol-1
C.��֪N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.4kJ��mol-1������һ�������½�1mol N2��3mol H2����һ�ܱ������г�ַ�Ӧ���ų�92.4kJ������
2NH3(g) ��H=-92.4kJ��mol-1������һ�������½�1mol N2��3mol H2����һ�ܱ������г�ַ�Ӧ���ų�92.4kJ������
D.��֪��Ȳ��ȼ����Ϊ![]() �����ʾ��Ȳȼ���ȵ��Ȼ�ѧ����ʽΪ
�����ʾ��Ȳȼ���ȵ��Ȼ�ѧ����ʽΪ![]() ��H=
��H=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2+O2(g)![]() 2SO3(g) ��H��0������Ӧ�ﵽƽ��ʱ,���д�ʩ:
2SO3(g) ��H��0������Ӧ�ﵽƽ��ʱ,���д�ʩ:
�ٽ��� �ں���ͨ��������� ������SO2��Ũ�� �ܼ�ѹ �ݼӴ��� ��ѹͨ��������� ������O2��Ũ�� �ཫ���ѹ����ԭ����һ�룬�����SO2ת���ʵ���( )
A.�٢ڢ�B.�ܢޢ�C.�٢ߢ�D.�ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
(1)��ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪC(s)��H2O(g)![]() CO(g)��H2(g) ��H����131.3 kJ��mol��1�� �÷�Ӧ�ڳ�����________����ܡ����ܡ����Է����С�
CO(g)��H2(g) ��H����131.3 kJ��mol��1�� �÷�Ӧ�ڳ�����________����ܡ����ܡ����Է����С�
(2)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g) ![]() CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
�÷�Ӧ������ӦΪ________��������š����ȷ�Ӧ��ʵ��2������ƽ�ⳣ��K��________��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol��1���ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2���ﵽƽ������д�ʩ����ʹc(CH3OH)�������________��
CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol��1���ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2���ﵽƽ������д�ʩ����ʹc(CH3OH)�������________��

a�������¶�
b������He(g)��ʹ��ϵѹǿ����
c����H2O(g)����ϵ�з������
d���ٳ���1 mol CO2��3 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ��������ƽ�⣬�ش��������⣺
(1)Na2SO3ˮ��Һ��________________������������������������������ ��ԭ���ǣ������ӷ���ʽ����______________________________��
(2)��֪T ��ʱ����ˮ��c(OH)Ϊ10-6 mol��L-1����
�����¶�ʱ0.1mol��L-1NaOH��ҺpHΪ___________________��
�����¶��£���pH��2 ��H2SO4��Һ��pH��9��NaOH��Һ�������1:9��ϣ�������Һ����仯�������û����Һ��pHΪ________
�����¶��£���1���pH1��a��ijǿ����Һ��10���pH2��b��ijǿ����Һ��Ϻ���Һ�����ԣ�������Һ����仯��������ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��___________��
(3)�����£���25mL������������Һ����μ���0.2mol��L-1������Һ���ζ�������ͼ��ʾ��
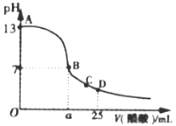
����B�㣬��Һ��n(CH3COO-)Ϊ______________________________��
����D�㣬c(CH3COO) _________ c(Na+) (���������������=��)��
�������½�0.02mol CH3COONa��0.01mol��������ˮ�����1L�����Һ��д����Һ�и�����Ũ�ȵĴ�С��ϵΪ___________________________��
(4)�����£���0.1mol��L-1����ͭ��Һ�м�����������ϡ��Һ����ֽ�����dz��ɫ������ͭ�������ɣ�����ҺpHΪ8ʱ��c(Cu2+)=________������֪����ʱCu(OH)2��Ksp=2.2��10-20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ��� FeS2��ij���᳧�ڽ��л�����ɷֲⶨʱ��ȡ 0.1000 g ��Ʒ�ڿ����г�����գ������ɵ�SO2����������Fe2(SO4)3��Һ��ȫ��Ӧ����Ũ��Ϊ 0.02000 mol��L-1�� K2Cr2O7����Һ�ζ����յ㣬�ظ�ʵ�飬ƽ������K2Cr2O7����Һ 20.00mL��
��1�����Ṥҵ�����ջ�������豸����_____��
��2������ƷFeS2����������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n
B.һ������������������ȼ�ղ�ͨ��Ũ���ᣬ���ٵ�������������ɵ�ˮ���������
C.ij��̬��CxHy������O2ǡ����ȫ��Ӧ�������Ӧǰ�������������(�¶�>100��)����y��4���������С����y>4������y<4
D.��ͬ������������ȫȼ�գ�����O2Խ�࣬���к�H��Խ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com