
【题目】反应A+B → C分两步进行:①A+B →X,②X → C,能量变化如图所示(E1、E2、E3均大于0),下列有关叙述正确的是

A.反应A+B→C的热效应为 (E3 - E1) kJ
B.反应X→C为吸热反应
C.X是反应A+B→C的催化剂
D.反应 A+B→X的热效应为 - (E1 - E2) kJ
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
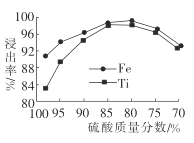
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为__mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__mol
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=__,y=__。平衡时,B的物质的量__(填编号)。
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是__。
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较__(填编号)。作出此判断的理由是__。
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂、氦、汞原子的吸收光谱和发射光谱。其中图______是原子由基态转化为激发态时的光谱,图______是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在图中将同种元素原子的吸收光谱和发射光谱连接起来______。
①![]() ②
②![]()
③![]() ④
④![]()
⑤![]() ⑥
⑥![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O![]() HCl+HClO,写出该反应化学平衡常数的表达式_____________
HCl+HClO,写出该反应化学平衡常数的表达式_____________
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
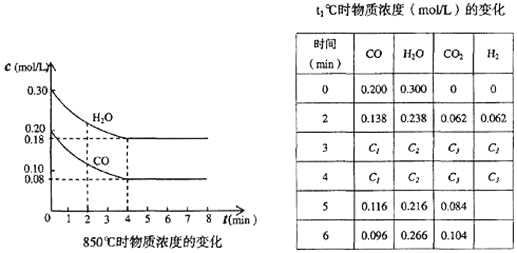
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com