
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4在一定条件下合成乙酸:CO2+CH4![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)①写出碳原子最外电子层的轨道表示式______
②钛(Ti)是22号元素,它是______(选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(2)CS2分子的电子式为______;其熔沸点比CO2高,原因是______常温下,向1L pH=10的 NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离产生的OH﹣离子浓度(c)的关系如图所示
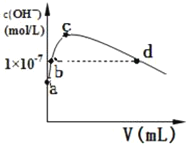
(3)c点溶液中离子浓度由大至小的关系是:______
(4)a点溶液中由水电离产生的c(H+)=______;b点溶液中c(H+)______1×10﹣7mol/L(填写“等于”、“大于”或“小于”)
(5)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是______(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。

已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为元素周期表中前20号元素,其原子序数依次增大。其中
为元素周期表中前20号元素,其原子序数依次增大。其中![]() 、
、![]() 是金属元素;
是金属元素;![]() 和
和![]() 同主族,它们原子的最外层电子排布式均为
同主族,它们原子的最外层电子排布式均为![]() ;
;![]() 和
和![]() 同主族,它们原子最外层的
同主族,它们原子最外层的![]() 能级电子数是
能级电子数是![]() 能级电子数的2倍;
能级电子数的2倍;![]() 元素原子最外层电子数是
元素原子最外层电子数是![]() 元素原子最外层电子数的
元素原子最外层电子数的![]() 。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
(1)![]() 是______(填元素符号,下同),
是______(填元素符号,下同),![]() 是______,
是______,![]() 是______,
是______,![]() 是______,
是______,![]() 是______。
是______。
(2)五种元素中金属性最强的是______(填元素符号,下同),非金属性最强的是______。
(3)当![]() 与
与![]() 、
、![]() 、
、![]() 分别形成化合物时,
分别形成化合物时,![]() 显______(填“正”或“负”,下同)价,其他元素显______价。
显______(填“正”或“负”,下同)价,其他元素显______价。
(4)当![]() 与
与![]() 、
、![]() 、
、![]() 、
、![]() 分别形成简单化合物(其中
分别形成简单化合物(其中![]() 、
、![]() 、
、![]() 、
、![]() 均显最高价,
均显最高价,![]() 显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,欲使CH3COONa的稀溶液中![]() 比值增大,可在溶液中加入少量下列物质中的( )
比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A.只有①②B.只有③⑤C.只有②④⑤D.只有①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B → C分两步进行:①A+B →X,②X → C,能量变化如图所示(E1、E2、E3均大于0),下列有关叙述正确的是

A.反应A+B→C的热效应为 (E3 - E1) kJ
B.反应X→C为吸热反应
C.X是反应A+B→C的催化剂
D.反应 A+B→X的热效应为 - (E1 - E2) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液存在离子平衡,回答下列问题:
(1)Na2SO3水溶液呈________________(填“酸”、“中”、“碱”)性 ,原因是(用离子方程式):______________________________;
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为___________________。
②该温度下,将pH=2 的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为________
③该温度下,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___________。
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。
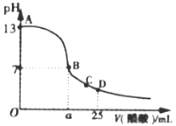
①在B点,溶液中n(CH3COO-)为______________________________。
②在D点,c(CH3COO) _________ c(Na+) (填“<”、“>”或“=”)。
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,配成1L混合溶液。写出溶液中各离子浓度的大小关系为___________________________。
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液pH为8时,c(Cu2+)=________。(已知常温时Cu(OH)2的Ksp=2.2×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com