
【题目】水溶液存在离子平衡,回答下列问题:
(1)Na2SO3水溶液呈________________(填“酸”、“中”、“碱”)性 ,原因是(用离子方程式):______________________________;
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为___________________。
②该温度下,将pH=2 的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为________
③该温度下,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___________。
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。
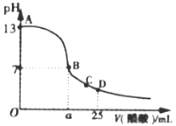
①在B点,溶液中n(CH3COO-)为______________________________。
②在D点,c(CH3COO) _________ c(Na+) (填“<”、“>”或“=”)。
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,配成1L混合溶液。写出溶液中各离子浓度的大小关系为___________________________。
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液pH为8时,c(Cu2+)=________。(已知常温时Cu(OH)2的Ksp=2.2×10-20)
【答案】碱 SO32-+H2O![]() HSO3- +OH- 11 4 a+b=11 0.0025mol >
HSO3- +OH- 11 4 a+b=11 0.0025mol > ![]() 2.2×10-8mol/L
2.2×10-8mol/L
【解析】
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则c(H+)也为10-6 mol·L-1,则该温度下水的电离平衡常数Kw= c(OH)·c(H+)=10-12;
(3)常温下,未滴加醋酸溶液时氢氧化钠溶液的pH=13,则其浓度为0.1mol/L。
(1)Na2SO3水溶液中SO32-会水解,所以溶液显碱性,方程式为:SO32-+H2O![]() HSO3- +OH-;
HSO3- +OH-;
(2)①0.1 mol·L-1NaOH溶液中c(OH)=0.1 mol·L-1,该温度下水的电离平衡常数Kw=10-12,所以溶液中c(H+)=10-11mol/L,所以pH=11;
②pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=9的NaOH溶液c(OH)=10-3mol/L,设硫酸的体积为1L,则氢氧化钠溶液的体积为9L,可知酸过量,所以混合后溶液呈酸性,c(H+)=![]() ,所以溶液pH=4;
,所以溶液pH=4;
③pH1=a的某强酸溶液c(H+)=10-amol/L,pH2=b的某强碱溶液中c(OH)=10b-12mol/L,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,所以10-amol/L×1=10b-12mol/L×10,解得a+b=11;
(3) 常温下,未滴加醋酸溶液时氢氧化钠溶液的pH=13,则其浓度为0.1mol/L。
①B点溶液中存在电荷守恒:c(OH)+ c(CH3COO-)=c(H+)+c(Na+),溶液呈中性,则c(OH)=c(H+),所以c(CH3COO-)=c(Na+),由于是在同一溶液中,所以n(CH3COO-)=n(Na+),据分析可知氢氧化钠溶液的浓度为0.1mol/L,所以25mL该溶液中n(Na+)=0.0025mol,所以B点n(CH3COO-)=0.0025mol;
②D点加入25mL0.2mol/L的醋酸溶液,则溶液中的溶质为等物质的量的CH3COONa和CH3COOH,电解质溶液呈酸性,c(H+)>c(OH),根据电荷守恒c(OH)+ c(CH3COO-)=c(H+)+c(Na+),所以c(CH3COO)>c(Na+);
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,发生反应CH3COONa+HCl=CH3COOH+NaCl,配成1L混合溶液,则溶液中的溶质为等物质的量的CH3COONa、CH3COOH和NaCl,类似于曲线上的D点,溶液呈酸性,c(H+)>c(OH),醋酸电离呈酸性,醋酸根水解呈碱性,则c(CH3COO)>c(CH3COOH),根据物料守恒,c(CH3COO)+ c(CH3COOH)=2 c(Cl-),可得c(CH3COO)>c(Cl-),综合可得所以溶液中的例子浓度大小关系为:![]() ;
;
(4) Ksp[Cu(OH)2]= c2(OH)·c(Cu 2+)=2.2×10-20,pH=8则溶液中c(OH)=10-6mol/L,所以c(Cu 2+)=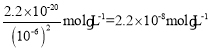 。
。


科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂、氦、汞原子的吸收光谱和发射光谱。其中图______是原子由基态转化为激发态时的光谱,图______是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在图中将同种元素原子的吸收光谱和发射光谱连接起来______。
①![]() ②
②![]()
③![]() ④
④![]()
⑤![]() ⑥
⑥![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________。
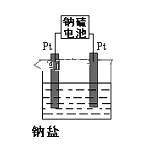
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________。
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS![]() Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO+Br2→CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3·H2O+H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有 Na+、K+、NH4+、Cu2+、SO42-、SO32-、MnO4-、Cl-、Br-、CO32-等离子,且所含离子的物质的量的浓度都相等。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成了如下实验:
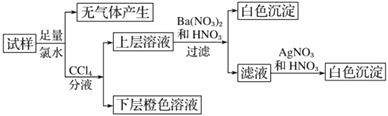
则关于原溶液组成的判断中正确的是:
A.肯定不存在的离子是 Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+另需实验验证;
B.肯定存在的离子是SO32-、Br-,且Na+、K+至少有一种存在;
C.无法确定原溶液中是否存在Cl-;
D.若步骤中Ba(NO3)2和HNO3溶液改用 BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O![]() HCl+HClO,写出该反应化学平衡常数的表达式_____________
HCl+HClO,写出该反应化学平衡常数的表达式_____________
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
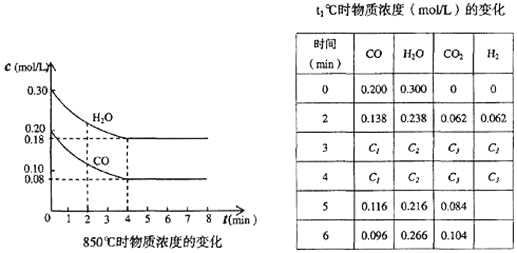
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶盐CaCO3在下列溶液中溶解度最大的是( )
A.0.1 mol·L-1CH3COOHB.0.10 mol·L-1CaSO4C.纯水D.1.0 mol·L-1Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com