
【题目】在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________。
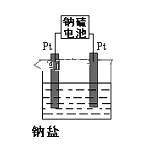
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS![]() Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
【答案】A CH4-8e- +4CO32-=5CO2+2H2O MgCl2+2H2O ![]() Cl2↑+H2↑+Mg(OH)2↓ 0.8mol Cu+2H2O
Cl2↑+H2↑+Mg(OH)2↓ 0.8mol Cu+2H2O![]() Cu(OH)2+H2↑
Cu(OH)2+H2↑ ![]()
【解析】
(3)电解质中与电源负极相连的为阴极得电子发生还原反应,与电源正极相连的为阳极失电子发生氧化反应,即X为阴极,Y为阳极。
(1)首先要设计成原电池必须是氧化还原反应,则B不可行,能设计成原电池的反应通常是放热反应,即△H<0,所以A符合;
(2)所选反应为CH4(g)+O2(g)=CO2(g)+H2O(g) ,原电池中负极失电子发生氧化反应,所以负极反应物为甲烷,失电子被氧化,结合电解质为熔融KCO3,可得电极反应方程式为:CH4-8e- +4CO32-=5CO2+2H2O;
(3)①电解过程中,阳离子在阴极放电,MgCl2溶液中H+先于Mg2+反应,所以阳极氢离子得电子生成氢气,阴离子在阳极放电,Cl-先于OH-反应,失电子生成氯气,溶液中剩余的Mg2+和OH-结合生成Mg(OH)2,所以电解时总反应为:MgCl2+2H2O ![]() Cl2↑+H2↑+Mg(OH)2↓;
Cl2↑+H2↑+Mg(OH)2↓;
②电解CuSO4溶液时阴极先是铜离子反应,当Cu2+反应完后H+反应,但阳极一直是OH-放电生成O2,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,说明电解过程中阳极产生的氧气为0.2mol,生成1个氧气分子转移4个电子,所以生成0.2mol O2转移的电子的物质的量为0.8mol;
③若Y为铜,即电解池的阳极为铜,此时阳极反应为:Cu-2e-+2H2O= Cu(OH)2+2 H+,阴极为H+反应,电极方程式为:2H++2e-=H2,所以总反应为:Cu+2H2O![]() Cu(OH)2+H2↑;
Cu(OH)2+H2↑;
(4)由原电池原理可知放电时,S得电子发生还原反应,所以S作正极,正极反应为xS+2e-=Sx2-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。

已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的一组是
![]() 纤维素、油脂、蛋白质一定条件下在人体内都能发生水解反应
纤维素、油脂、蛋白质一定条件下在人体内都能发生水解反应
![]() “乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
![]() 除去乙酸乙酯中残留的乙酸,可加过量饱和
除去乙酸乙酯中残留的乙酸,可加过量饱和![]() 溶液振荡后,静置分液
溶液振荡后,静置分液
![]() 石油的裂化、煤的干馏、煤的液化都是化学变化
石油的裂化、煤的干馏、煤的液化都是化学变化
![]() 淀粉遇碘酒变蓝色,葡萄糖能与新制
淀粉遇碘酒变蓝色,葡萄糖能与新制![]() 悬浊液发生反应.
悬浊液发生反应.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2(g)![]() 2SO3(g) △H<0,当反应达到平衡时,下列措施:
2SO3(g) △H<0,当反应达到平衡时,下列措施:
①降温 ②恒容通入惰性气体 ③增加SO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增大O2的浓度 ⑧将体积压缩到原来的一半,能提高SO2转化率的是( )
A.①②④B.④⑥⑦C.①⑦⑧D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) ![]() PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
A.1.6molB.小于1.6molC.0.8molD.大于1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液存在离子平衡,回答下列问题:
(1)Na2SO3水溶液呈________________(填“酸”、“中”、“碱”)性 ,原因是(用离子方程式):______________________________;
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为___________________。
②该温度下,将pH=2 的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为________
③该温度下,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___________。
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。
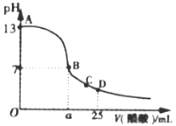
①在B点,溶液中n(CH3COO-)为______________________________。
②在D点,c(CH3COO) _________ c(Na+) (填“<”、“>”或“=”)。
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,配成1L混合溶液。写出溶液中各离子浓度的大小关系为___________________________。
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液pH为8时,c(Cu2+)=________。(已知常温时Cu(OH)2的Ksp=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示。下列说法中不正确的是( )
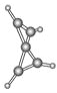
A. 该分子的分子式为C5H4
B. 该分子中碳原子的化学环境有2种
C. 该分子中的氢原子分布在两个相互垂直的平面上
D. 该分子中只有C—C键,没有![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯巴比妥是1903年就开始使用的安眠药,其合成路线如图(部分试剂和产物略)。
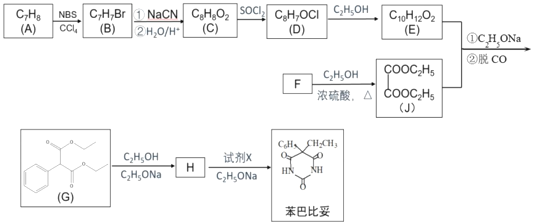
已知:①NBS是一种溴代试剂
②![]() +
+![]()
![]()
![]() + C2H5OH
+ C2H5OH
③R1—COOC2H5+![]()
![]()
![]() +C2H5OH
+C2H5OH
请回答下列问题:
(1)下列说法正确的是__________
A. 1 mol E在NaOH溶液中完全水解,需要消耗2 mol NaOH
B. 化合物C可以和FeCl3溶液发生显色反应
C. 苯巴比妥具有弱碱性
D. 试剂X可以是CO(NH2)2
(2)B中官能团的名称__________,化合物H的结构简式为_______。
(3)D→E的化学方程式为_________。
(4)苯巴比妥的一种同系物K,分子式为C10H8N2O3,写出K同时符合下列条件的同分异构体的结构简式______
①分子中含有两个六元环;且两个六元环结构和性质类似
②能够和FeCl3发生显色反应
③核磁共振氢谱显示分子中由5种氢
(5)参照流程图中的反应,设计以甲苯为原料合成聚酯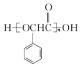 __________(用流程图表示,无机试剂任选)
__________(用流程图表示,无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化 |
D | 证明溴乙烷的消去反应有乙烯生成 | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com