
【题目】苯巴比妥是1903年就开始使用的安眠药,其合成路线如图(部分试剂和产物略)。
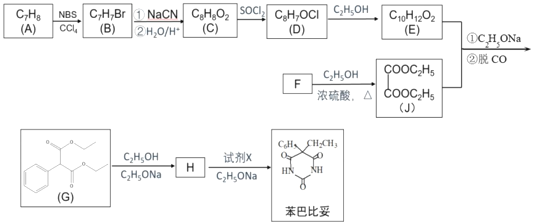
已知:①NBS是一种溴代试剂
②![]() +
+![]()
![]()
![]() + C2H5OH
+ C2H5OH
③R1—COOC2H5+![]()
![]()
![]() +C2H5OH
+C2H5OH
请回答下列问题:
(1)下列说法正确的是__________
A. 1 mol E在NaOH溶液中完全水解,需要消耗2 mol NaOH
B. 化合物C可以和FeCl3溶液发生显色反应
C. 苯巴比妥具有弱碱性
D. 试剂X可以是CO(NH2)2
(2)B中官能团的名称__________,化合物H的结构简式为_______。
(3)D→E的化学方程式为_________。
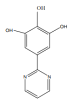
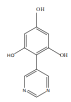
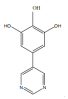
(4)苯巴比妥的一种同系物K,分子式为C10H8N2O3,写出K同时符合下列条件的同分异构体的结构简式______
①分子中含有两个六元环;且两个六元环结构和性质类似
②能够和FeCl3发生显色反应
③核磁共振氢谱显示分子中由5种氢
(5)参照流程图中的反应,设计以甲苯为原料合成聚酯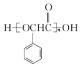 __________(用流程图表示,无机试剂任选)
__________(用流程图表示,无机试剂任选)
【答案】CD 溴原子 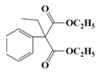
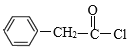 +C2H5OH
+C2H5OH![]()
![]() +HCl
+HCl 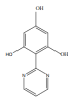 、
、 、
、 、
、
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
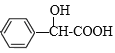
![]()
【解析】
根据物质的A、B分子式及反应条件可知A是![]() ,A与NBS反应产生B是
,A与NBS反应产生B是![]() ,B与NaCN发生取代反应,然后酸化,可得C:
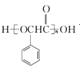
,B与NaCN发生取代反应,然后酸化,可得C:![]() ,C与SOCl2发生取代反应产生D:
,C与SOCl2发生取代反应产生D: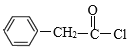 ,D与乙醇发生酯化反应产生E:
,D与乙醇发生酯化反应产生E:![]() ,根据F与乙醇发生酯化反应产生J,根据J的结构简式可知F结构简式为:HOOC-COOH,E、J反应产生G:
,根据F与乙醇发生酯化反应产生J,根据J的结构简式可知F结构简式为:HOOC-COOH,E、J反应产生G: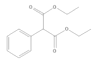 ,G与C2H5OH与C2H5ONa作用下发生取代反应产生H:
,G与C2H5OH与C2H5ONa作用下发生取代反应产生H: ,I在一定条件下发生反应产生苯巴比妥:
,I在一定条件下发生反应产生苯巴比妥: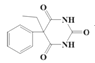 。据此分析解答。
。据此分析解答。
根据上述分析可知A是![]() ;B是
;B是![]() ;C是
;C是![]() ;D是
;D是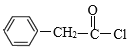 ;E是
;E是![]() ;F是HOOC-COOH;J是C2H5OOC-COOC2H5;G是
;F是HOOC-COOH;J是C2H5OOC-COOC2H5;G是 ;H是
;H是 。
。
(1)A. E结构简式是![]() ,含有酯基,在NaOH溶液中完全水解产生
,含有酯基,在NaOH溶液中完全水解产生![]() 和C2H5OH,所以1 mol E 完全水解,需消耗1 mol NaOH,A错误;
和C2H5OH,所以1 mol E 完全水解,需消耗1 mol NaOH,A错误;
B. 化合物C为![]() ,分子中无酚羟基,与FeCl3溶液不能发生显色反应,B错误;
,分子中无酚羟基,与FeCl3溶液不能发生显色反应,B错误;
C. 苯巴比妥上含有亚氨基,能够结合H+,故具有弱碱性,C正确;
D. 根据H与苯巴比妥的分子结构可知试剂X是CO(NH2)2,D正确;
故合理选项是CD;
(2)B结构简式为:![]() ,B中官能团的名称溴原子,化合物H的结构简式为
,B中官能团的名称溴原子,化合物H的结构简式为 ;
;
(3)D是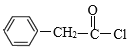 ,E是
,E是![]() ;D→E的化学方程式为
;D→E的化学方程式为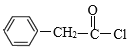 +C2H5OH
+C2H5OH![]()
![]() +HCl。
+HCl。
(4)根据苯巴比妥结构简式可知其分子式为C12H12N2O3,苯巴比妥的一种同系物K,分子式为C10H8N2O3,说明K比苯巴比妥少两个CH2原子团,且同时符合下列条件:①分子中含有两个六元环;且两个六元环结构和性质类似,
②能够和FeCl3发生显色反应,说明含有酚羟基;
③核磁共振氢谱显示分子中由5种氢,说明有5种不同结构的H原子,则其可能的结构为: 、
、 、
、 、
、 ;
;
(5)甲苯与与NBS在CCl4溶液中发生取代反应产生![]() ,
,![]() 与NaCN发生取代反应然后酸化得到
与NaCN发生取代反应然后酸化得到![]() ,
,![]() 与NBS在CCl4溶液中发生取代反应产生
与NBS在CCl4溶液中发生取代反应产生![]() ,该物质与NaOH的水溶液混合加热,然后酸化可得
,该物质与NaOH的水溶液混合加热,然后酸化可得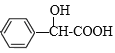 ,该物质在催化剂存在条件下,加热发生反应产生
,该物质在催化剂存在条件下,加热发生反应产生 ,所以转化流程为:
,所以转化流程为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
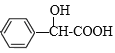
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为__mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__mol
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=__,y=__。平衡时,B的物质的量__(填编号)。
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是__。
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较__(填编号)。作出此判断的理由是__。
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________。
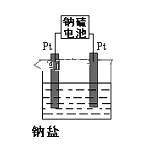
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS![]() Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有 Na+、K+、NH4+、Cu2+、SO42-、SO32-、MnO4-、Cl-、Br-、CO32-等离子,且所含离子的物质的量的浓度都相等。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成了如下实验:
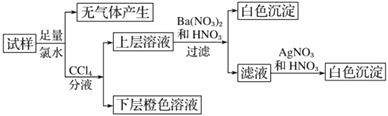
则关于原溶液组成的判断中正确的是:
A.肯定不存在的离子是 Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+另需实验验证;
B.肯定存在的离子是SO32-、Br-,且Na+、K+至少有一种存在;
C.无法确定原溶液中是否存在Cl-;
D.若步骤中Ba(NO3)2和HNO3溶液改用 BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O![]() HCl+HClO,写出该反应化学平衡常数的表达式_____________
HCl+HClO,写出该反应化学平衡常数的表达式_____________
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
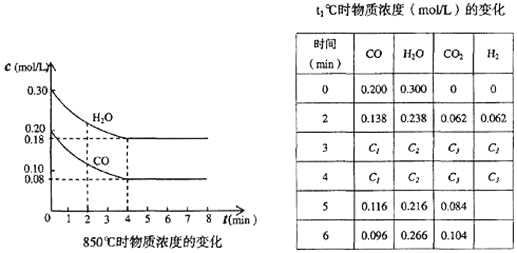
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
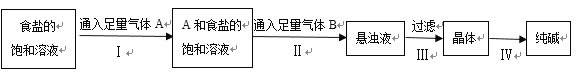
A.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+
B.第Ⅲ步得到的晶体是Na2CO310H2O
C.A气体是CO2,B气体是NH3
D.第Ⅳ步操作的过程主要有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A装置常用于实验室制备气体
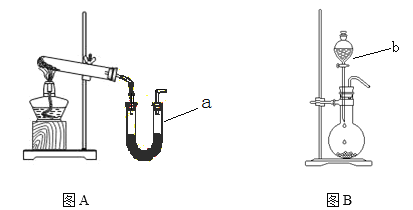
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
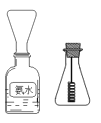
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___________调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)=_____________。
(2)过滤后,将所得滤液经过________,________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。过滤后,滤液用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O32-=S4O32-+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com