
【题目】几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___________调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)=_____________。
(2)过滤后,将所得滤液经过________,________操作,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是________________。
(4)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。过滤后,滤液用0.1000 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O32-=S4O32-+2I-)。
①可选用________作滴定指示剂,滴定终点的现象是__________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
【答案】CuO或Cu(OH)2或碱式碳酸铜等 2.6×10-9mol/L 蒸发浓缩 冷却结晶 在干燥的HCl气流中加热 淀粉 当滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且在半分钟内不变色 2Cu2++4I-=2CuI↓+I2 85.5%
【解析】
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入能与H+反应的含铜化合物,调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)可利用Ksp进行计算。
(2)过滤后,将所得滤液经过蒸发浓缩、冷却结晶,可得到CuCl2·2H2O晶体。
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是加热,但同时又需抑制水解反应的发生。
(4)①可选用与I2有明显现象的物质作滴定指示剂。
②CuCl2溶液与KI发生氧化还原反应,生成I2、CuI等。
③利用Cu2+与I-的反应和I2+2S2O32-=S4O32-+2I-,建立2(CuCl2·2H2O)~I2~2S2O32-的关系式,求出该试样中CuCl2·2H2O的质量百分数。
(1)为制得纯净CuCl2溶液,宜加入CuO或Cu(OH)2或碱式碳酸铜等,调至溶液pH=4,使Fe3+转化为Fe(OH) 3沉淀,此时溶液中的c(Fe3+)=![]() =2.6×10-9mol/L。答案为:CuO或Cu(OH)2或碱式碳酸铜等;2.6×10-9mol/L;
=2.6×10-9mol/L。答案为:CuO或Cu(OH)2或碱式碳酸铜等;2.6×10-9mol/L;
(2)过滤后,将所得滤液经过蒸发浓缩,冷却结晶操作,可得到CuCl2·2H2O晶体。答案为:蒸发浓缩;冷却结晶;
(3)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要加热,由于该晶体直接加热发生水解不能获得无水CuCl2,故需要抑制水解反应的发生,需要进行的操作是:在干燥的HCl气流中加热。答案为:在干燥的HCl气流中加热;
(4)①由于反应有I2生成,可选用淀粉作滴定指示剂,滴定终点的现象是当滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且在半分钟内不变色。答案为:淀粉;当滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且在半分钟内不变色;
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2。答案为:2Cu2++4I-=2CuI↓+I2;
③由关系式2(CuCl2·2H2O)~I2~2S2O32-可得出,n(CuCl2·2H2O)=n(S2O32-)= 0.1000 mol·L-1×0.04L=0.004mol,该试样中CuCl2·2H2O的质量百分数为![]() =85.5%。答案为:85.5%。
=85.5%。答案为:85.5%。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】分别用等量的铁与足量的稀硫酸和足量的CuO制备单质铜,有人设计了以下两种方案:①Fe![]() H2
H2![]() Cu,②CuO
Cu,②CuO![]() CuSO4
CuSO4![]() Cu,对制备得到Cu的量,下列判断正确的是( )
Cu,对制备得到Cu的量,下列判断正确的是( )
A.一样多
B.②多
C.①多
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法不正确的是
为阿伏加德罗常数的值,下列说法不正确的是 ![]()
![]()
A.![]() 的
的![]() 中含有的质子数与中子数均为
中含有的质子数与中子数均为![]()
B.![]() 的
的![]() 的核内中子数为N,质量数为
的核内中子数为N,质量数为![]() 的核外电子数为
的核外电子数为![]()
C.![]() 与
与![]() 混合气体中含
混合气体中含![]() 键的数目为
键的数目为![]()
D.![]() 和
和![]() 的固体混合物中含有的阳离子数为
的固体混合物中含有的阳离子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.氨气通入醋酸溶液中 CH3COOH+NH3=CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH-=H2O
C.碳酸钡溶于醋酸 BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应 2Na+H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,22.4L SO3含NA个分子
B.含0.4mol HCl的浓盐酸与足量二氧化锰反应转移电子数为0.2NA
C.32gCu与足量硫完全反应,转移的电子数为0.5NA
D.在200mL 5mol·L-1 AlCl3溶液中,Al3+数目为NA,等于Cl-数目的1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是![]()
![]()
A.![]() 葡萄糖和
葡萄糖和![]() 果糖的混合物中羟基数目为
果糖的混合物中羟基数目为![]()
B.标准状况下,![]() 一氟甲烷中H原子数目为
一氟甲烷中H原子数目为![]()
C.![]() 溶液中离子总数大于
溶液中离子总数大于![]()
D.![]() 在稀硫酸作用下水解生成乙醇分子数目为
在稀硫酸作用下水解生成乙醇分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+2B(g)![]() C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
0 | 40 | 80 | 120 | 160 | |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
根据表中数据,下列说法正确的是
A.乙容器中的反应温度T<300
B.丙容器中,0-40min内用A的浓度变化表示的平均反应速率为为0.05mol/(L·min)
C.若起始时向甲容器中加入0.2、0.2、0.4和1.2,则反应将向正反应方向进行
D.在0-40min内,提高乙容器中的A的转化率的有效途径是使用高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:ZnS呈白色,CuS呈黑色;常温下,Ksp(ZnS)=3.0×10-25,Ksp(CuS)=1.0×10-36;pM=-lgc(M2+)。常温下,向10.0mL0.20molL-1ZnCl2溶液中逐滴滴加0.10molL-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法不正确的是( )
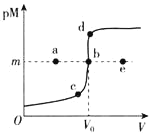
A.V0=20.0mL,m=12.5-![]() lg3
lg3
B.相同实验条件下,若用10.0mL0.20molL-1CuCl2溶液代替上述ZnCl2溶液,则反应终点b向d方向移动
C.若c(ZnCl2)=0.10molL-1,则反应终点可能为e点
D.向b点浊液中加入0.002molCuCl2固体,白色沉淀变黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com