
【题目】2SO2+O2(g)![]() 2SO3(g) △H<0,当反应达到平衡时,下列措施:
2SO3(g) △H<0,当反应达到平衡时,下列措施:
①降温 ②恒容通入惰性气体 ③增加SO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦增大O2的浓度 ⑧将体积压缩到原来的一半,能提高SO2转化率的是( )
A.①②④B.④⑥⑦C.①⑦⑧D.③⑤⑥
【答案】C
【解析】
该反应焓变小于零正反应为放热反应,反应物气体系数之和大于生成物气体系数之和,为压强减小的反应。
①该反应为放热反应,降温使平衡右移,二氧化硫转化率增大,故正确;
②恒容通入惰性气体体系压强虽然增大,但各反应物的浓度不变,故平衡不移动,故错误;
③增加SO2的浓度虽然平衡右移,但二氧化硫的转化率降低,故错误;
④该反应正反应为压强减小的反应,减压会使平衡左移,降低二氧化硫转化率,故错误;
⑤加催化剂不会影响平衡,故错误;
⑥恒压通入惰性气体,各反应物的浓度会减小,相当于扩大体积,平衡会向左移动,二氧化硫转化率降低,故错误;
⑦增大O2的浓度平衡右移,二氧化硫的转化增大,故正确;
⑧将体积压缩到原来的一半后压强增大,平衡右移,二氧化硫的转化率增大,故正确;
综上①⑦⑧符合题意,答案为C。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】由碳、氢、氧三种元素组成的有机物![]() 的相对分子质量为102,所含氢元素的质量分数为
的相对分子质量为102,所含氢元素的质量分数为![]() ,分子中氢原子数为氧原子数的5倍。
,分子中氢原子数为氧原子数的5倍。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,
中含有2个不同的含氧官能团,分别为羟基和醛基。一定条件下,![]() 与氢气反应生成
与氢气反应生成![]() ,
,![]() 分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则
分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团,则![]() 的结构简式为______。
的结构简式为______。
(3)写出两个与![]() 具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
具有相同官能团,并带有支链的同分异构体的结构简式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为__mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__mol
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=__,y=__。平衡时,B的物质的量__(填编号)。
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是__。
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较__(填编号)。作出此判断的理由是__。
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锂、氦、汞原子的吸收光谱和发射光谱。其中图______是原子由基态转化为激发态时的光谱,图______是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在图中将同种元素原子的吸收光谱和发射光谱连接起来______。
①![]() ②
②![]()
③![]() ④
④![]()
⑤![]() ⑥
⑥![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,可逆反应:H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是( )
2HI (g)达到平衡的标志是( )
①H2、I2、HI的分子数之比为1∶1∶2
②混合气体的密度保持不变
③单位时间形成n mol H—H键,同时形成2n mol H—I键
④混合气体的颜色不再发生变化
⑤混合气体的平均相对分子质量不再发生变化
⑥容器压强不再发生变化
⑦H2的体积分数不再发生变化
A.①②④⑤B.③④C.③④⑦D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电时阴极反应:Cd(OH)2+2e- = Cd+2OH-
B.充电过程阳极附近溶液的碱性增强
C.放电时电能转化为化学能
D.放电时电解质溶液中消耗1molH2O时电路中通过2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________。
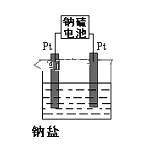
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS![]() Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有 Na+、K+、NH4+、Cu2+、SO42-、SO32-、MnO4-、Cl-、Br-、CO32-等离子,且所含离子的物质的量的浓度都相等。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成了如下实验:
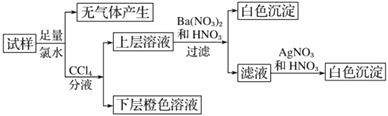
则关于原溶液组成的判断中正确的是:
A.肯定不存在的离子是 Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+另需实验验证;
B.肯定存在的离子是SO32-、Br-,且Na+、K+至少有一种存在;
C.无法确定原溶液中是否存在Cl-;
D.若步骤中Ba(NO3)2和HNO3溶液改用 BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A装置常用于实验室制备气体
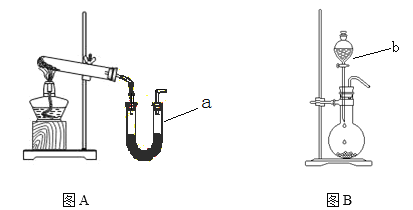
(1)写出实验室用该装置制备O2化学方程式 __________________________________。
(2)若利用该装置制备干燥NH3,试管中放置药品是_______________(填化学式);仪器 a中放置药品名称是________ 。
(3)图B装置实验室可用于制备常见的有机气体是_______。仪器b名称是_________。有学生利用图B装置用浓氨水和生石灰制备NH3,请说明该方法制取NH3的原因 。______________________________________________________________
(4)学生甲按图所示探究氨催化氧化
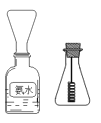
①用一只锥形瓶倒扣在浓氨水试剂瓶口收集氨气 ,然后将红热的螺旋状铜丝插入锥形瓶中;片刻,锥形瓶中气体变为红棕色。下列叙述正确的是_________
A.如图收集氨气是利用氨水的密度较小 B.锥形瓶必须干燥
C.收集氨气时间越长,红棕色现象越明显 D.铜丝能保持红热
②学生乙对学生甲的实验提出了异议,认为实验中产生的红棕色气体可能是空气中的氮气氧化后造成的,你认为学生乙的说法合理吗?请你设计一个简单实验证明学生乙的说法是否正确。_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com