
【题目】下列变化中,一定不存在化学能与热能相互转化的是( )。
A. 铝热反应B. 白磷自燃C. 干冰气化D. 燃放爆竹
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有金属元素的化合物一定是离子化合物
B. IA族和VIIA族元素原子化合时,一定生成离子键
C. 由非金属元素形成的化合物一定不是离子化合物
D. 活泼金属与活泼非金属化合时,能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。

(1)写出a点以前发生反应的化学方程式:___________________________________________________________________________________________。
(2)写出a到b点发生反应的化学方程式:____________________________________________________________________________________________。
(3)若某Na2CO3溶液中含mmol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于____mol(用含字母m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B 的转化率变大;当减小压强时,混合体系中 C 的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B 的转化率变大;当减小压强时,混合体系中 C 的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A 的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入 B(体积不变),则 B 的转化率_________。
(4)若 B 是有色物质,A、C 均无色,则加入 C(体积不变)时混合物颜色_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
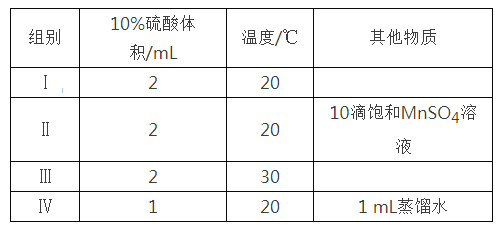
(1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下列四种溶液:①c(H+)=10-3mol·L-1的醋酸;②pH=5 的NH4Cl溶液; ③pH=10的Na2CO3溶液;④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为 ( )
A. 1∶106∶10∶1 B. 1∶106∶107∶1
C. 108∶106∶10∶1 D. 108∶106∶107∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的描述不符合事实的是
A.铝制容器可以贮运稀硫酸
B.氧化铁可用作外墙涂料
C.碳酸氢钠可用作焙制糕点发酵剂
D.五彩缤纷的烟花是利用了某些金属化合物的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O]的过程如图所示。下列说法正确的是( )

A.试剂①可选用NaOH溶液
B.过滤操作中使用的玻璃仪器只有漏斗、烧杯
C.滤液A到沉淀B的反应中有CO2生成
D.最后一步操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为CO2+3H2![]() CH3OH + H2O,请回答下列问题:
CH3OH + H2O,请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:

写出二氧化碳和氢气制备甲醇的热化学方程式_______________________________。
(2)如果只改变一个条件使上述反应的平衡常数K值变大,则该反应_____________。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同的时间后,CO2的转化率随反应温度的变化如图所示:

①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是____________。
②c点CO2的转化率高于b点,原因是_________________________________。
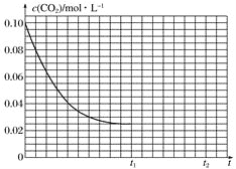
(4)常温常压下若反应的容器容积为2.0L,反应时间为4.0 min,容器里气体密度减少了2.0 g·,在这段时间内CO2平均反应速率为_____________。反应在t1时达到平衡,在这过程中c(CO2)随时间t变化的曲线如下图所示。保持其他条件不变,t1时将容器体积压缩到1 L,请在下图中画出t1后c(CO2)随时间t变化的趋势曲线(假设在t2时达到平衡)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com