
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L0.lmol·L-1Na2CO3溶液中含有CO32-数目小于0.1NA
B.Na2O2与CO2反应,每生成1molO2转移的电子数为NA
C.标准状况下,2.24L乙醇中含共价键数目为0.8NA
D.常温常压下,18gH218O含有10NA个电子
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.戊烷有2种同分异构体
B.C8H10中只有3种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
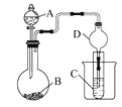
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.32 g S8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1 L 0.1 mol·L-1 H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
C.2 mol NO与2 mol O2在密闭容器中充分反应,转移的电子数为8NA
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,
,![]() 。若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是
。若在500℃和催化剂的作用下,反应在容积固定的密闭容器中进行,下列有关说法正确的是
A.达到平衡时,![]() 和
和![]() 的浓度一定相等
的浓度一定相等
B.反应体系中,当混合物的密度保持不变,反应达到平衡
C.使用催化剂、增大压强和升高温度均有利于加快反应速率
D.投入![]() 和
和![]() ,达平衡时反应放出热量为198.0 kJ
,达平衡时反应放出热量为198.0 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化乙炔(CHBr2-CHBr2)是一种无色液体,常用于合成季铵化合物.某同学在实验室模仿工业生产,以电石(主要成分CaC2,少量CaS,Ca3P2,Ca3As2等)和Br2等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示.已知:四溴化乙炔的熔点为1℃,沸点为244℃,密度为2.967g·cm-3,难溶于水.回答下列问题:
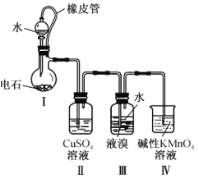
(1)装置Ⅰ中CaC2与水反应生成乙炔(C2H2)和氢氧化钙,写出该反应的化学方程式:__________________;该反应剧烈,为了得到平缓的C2H2气流,可采取的措施是____________(任写一条).
(2)装置Ⅱ的目的是_________________________________________
(3)装置Ⅲ中在液溴液面上加入一层水的目的是__________________________;装置Ⅲ中表明已反应完成的现象是______________________________________________________;已知装置Ⅲ反应后的体系含有多种物质,简述获得纯净四溴化乙炔的操作:________________________________________________
(4)装置Ⅳ的目的是除去未反应的乙炔.在碱性条件下,KMnO4与C2H2反应生成碳酸盐和MnO2,则该反应中参与反应的氧化剂和还原剂的物质的量之比为____________。
(5)实际工业生产中会产生大量的副产物Ca(OH)2,用于制备漂白粉,写出制备漂白粉的化学方程式: _____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出了金刚石,具有深远的意义。下列说法错误的是( )
A.该反应是氧化还原反应B.反应中二氧化碳完全被还原为金刚石
C.钠被氧化最终生成碳酸钠D.金刚石是碳的一种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
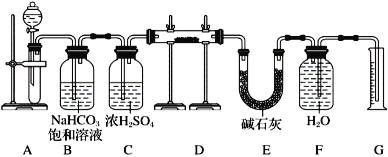
回答下列问题:
(1)连接好装置后需要进行的一步操作是:______,装置C的作用是________,装置E的作用是:____________。
(2)装置D中发生反应的化学方程式是__________、__________。
(3)若开始时测得样品的质量为2.2 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。(保留一位小数点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com