
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
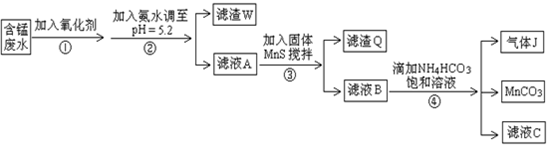
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(括号内为杂质) | 除杂方法 | |
| A | CO2(O2) | 灼热的铜网 |
| B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
| C | CaCl2溶液(盐酸) | 加入过量CaCO3,过滤 |
| D | CO2(CO) | 通入O2 点燃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火燃烧时,用泡沫灭火器灭火 |
| B、硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
| C、在新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液最终呈红色 |
| D、向Ba(OH)2溶液中慢慢滴加稀硫酸至过量,溶液的导电性变化是弱→强→弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B、钢铁在潮湿的空气中容易生锈 |
| C、温度过高对合成氨不利 |
| D、常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
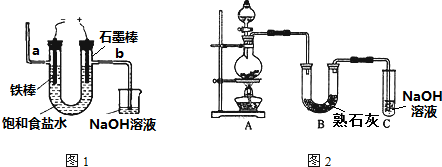
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、AlO2-、Br- |
| B、H+、Fe2+、SO42-、NO3- |
| C、K+、NH4+、CO32-、OH- |
| D、Ca2+、Al3+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com