
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。
【答案】H C O Na NH3 ![]() NaOH Mg(OH)2 HClO4 H2SO4 Na+
NaOH Mg(OH)2 HClO4 H2SO4 Na+![]() 离子 共价
离子 共价
【解析】
由元素在周期表中位置知,①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl。
(1)、①为H、③为C、⑤为O、⑦为Na;
(2)、①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为![]() ;
;
(3)、元素金属性越强,其最高价氧化物的水化物的碱性越强,则⑦和⑧号元素的最高价氧化物的水化物NaOH与Mg(OH)2的碱性是: NaOH﹥Mg(OH)2;元素非金属性越强,其最高价氧化物的水化物的酸性越强,则⑨和⑩号元素的最高价氧化物的水化物的酸性是:HClO4﹥H2SO4;
(4)、①、⑤、⑦号元素形成的一种化合物NaOH的电子式是Na+![]() ,在该化合物由钠离子和氢氧根离子构成,氢氧根离子中氢原子与氧原子之间存在共价键,故该化合物中既含有离子键,又含有共价键。
,在该化合物由钠离子和氢氧根离子构成,氢氧根离子中氢原子与氧原子之间存在共价键,故该化合物中既含有离子键,又含有共价键。


科目:高中化学 来源: 题型:
【题目】0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)eC(g)+fD(g),反应过程中, 当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )

A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n<e+f
D.达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g)其中容器Ⅰ中5min时到达平衡。
COCl2(g)其中容器Ⅰ中5min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO的转化率大80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的叙述正确的是( )
A.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好
B.天然蛋白质中仅含C、H、O、N四种元素
C.鸡蛋清加入食盐,会使蛋白质变性
D.一束光线照射蛋白质溶液,产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
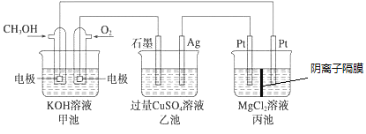
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com