
用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:
(1)
|
应取浓硫酸的体积/ml |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
(2)配制操作可分解成如下几步:
A.向容量瓶中注入少量蒸馏水,检查容量瓶是否漏水
B.用少量蒸馏水洗涤烧杯,将溶液注入容量瓶,并重复操作两次
C.将已冷却的硫酸注入容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀,装瓶
G.用胶头滴管继续加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
正确的操作顺序是:A____________________________F
(3)下列操作结果,使溶液物质的量浓度偏低的是
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量的溶液溅出
D.摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线
(1)5.0(2分),100(2分),量筒、烧杯、玻璃棒、胶头滴管(2分)
(2)DECBHG(3分) (3)AC(3分)
【解析】
试题分析:(1)用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,则根据稀释过程中溶质不变可知,需要浓硫酸的体积=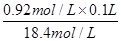 =0.005L=5.0ml,所以应取浓硫酸的体积是5.0ml。配制100ml硫酸,则需要100ml容量瓶。另外还需要量筒量取浓硫酸,稀释浓硫酸用烧杯,稀释和转移还需要玻璃棒,定容时还需要胶头滴管。
=0.005L=5.0ml,所以应取浓硫酸的体积是5.0ml。配制100ml硫酸,则需要100ml容量瓶。另外还需要量筒量取浓硫酸,稀释浓硫酸用烧杯,稀释和转移还需要玻璃棒,定容时还需要胶头滴管。
(2)容量瓶在使用前需要查漏,具体的操作步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,所以其操作顺序是A DECBHGF。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。A、没有将洗涤液转移到容量瓶中,则溶质减少,所配浓度偏低;B、容量瓶洗净后未经干燥处理不会影响实验结果,即浓度不变;C、转移过程中有少量的溶液溅出,则溶质减少,所配浓度偏低;D、摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线,浓度不变,因此答案选AC。
考点:考查一定物质的量浓度的配制、仪器选择以及误差分析等


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | B、将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | C、用胶头滴管加水时,俯视视观察溶液凹液面与容量瓶刻度相切 | D、用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com