
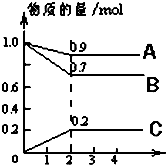
 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:分析 (1)根据图象可知A、B的量减少是反应物;根据物质的量的变化与化学计量数呈正比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$计算用C表示化学平均反应速率.
解答 解:(1)根据图象可知A、B的量减少是反应物;图象可以看出,反应到2min时,A的物质的量减小,变化值为1.0-0.9=0.1mol,B的物质的量减小,变化值为1.0mol-0.7mol=0.3mol,则A、B为反应物,C的物质的量增多,变化值为0.2mol,为生成物,根据物质的量的变化与化学计量数呈正比,则有n(A):n(B ):n(C )=0.1:0.3:0.2=1:3:2,
故答案为:A、B;A(g)+3B(g)?2C(g);
(2)反应开始至2min,用C表示化学平均反应速率为:v(C)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol•(L•min)-1,
故答案为:0.05mol•(L•min)-1.
点评 本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,试题培养了学生的分析、理解能力及灵活应用能力.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为3NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 0.1 mol/L的Na2CO3溶液中:c(Na+ )+2[c(CO3 2-)+c(HCO3-)+c(H2CO3)] | |
| C. | 浓度均为0.1mol•L-1 的碳酸钠溶液和氨水溶液中,由水电离的出的 c(OH-):前者大于后者 | |
| D. | 浓度为0.1 mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合溶液中pH>7,则:c(NH4+ )>c(Cl-)>c(OH-)>c(NH3•H2O)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
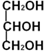 )与足量丙酸(CH3CH2COOH)发生酯化的反应方程式:
)与足量丙酸(CH3CH2COOH)发生酯化的反应方程式: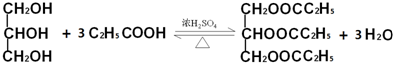
 若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.
若有气泡产生(且产生的气体可燃)则其结构为CH3CH2OH;如无明显现象,则为CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
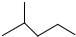 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.| 实验步骤 | 解释或实验结论 |
| (1)称取A物质 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: ?A的相对分子质量为:90 |
(2)A的核磁共振氢谱如图: | ?A中含有4种氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com