
【题目】现有A、B、C、D、E五种有机物,它们有如下相互转化关系:
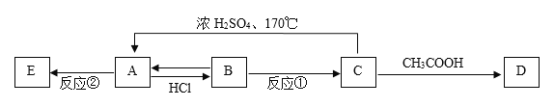
已知:A是相对分子质量为28的烃,E属于高分子化合物。请完成下列各题:
(1)物质A的名称是______________,物质D的结构简式为____________________。
(2)写出反应①的化学方程式:_______,该反应属于_____________反应。
(3)写出反应②的化学方程式:______________,该反应属于_____________反应。
【答案】乙烯 CH3COOCH2CH3 CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl 取代反应
CH3CH2OH+NaCl 取代反应 ![]() 加聚反应
加聚反应
【解析】
A是相对分子质量为28的烃,根据“商余法”,28÷14=2,所以A的分子式是C2H4,A是乙烯,乙烯发生加聚反应生成聚乙烯E;乙烯与氯化氢发生加成反应生成氯乙烷B,氯乙烷在氢氧化钠溶液中发生水解反应生成乙醇C,乙醇和乙酸发生酯化反应生成乙酸乙酯D,乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯。
(1)物质A的分子式是C2H4,结构简式是CH2=CH2,名称是乙烯,物质D是乙酸乙酯,结构简式为CH3COOCH2CH3。
(2)反应①是氯乙烷在氢氧化钠溶液中发生水解反应生成乙醇,化学方程式是CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl,该反应属于取代反应。
CH3CH2OH+NaCl,该反应属于取代反应。
(3)反应②是乙烯一定条件下生成聚乙烯,化学方程式是![]() ,该反应属于加聚反应。
,该反应属于加聚反应。


科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
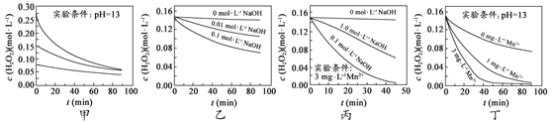
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞省去
夹持装置、活塞省去![]() 能够达到该目的是( )
能够达到该目的是( )
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护 | 酸化NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电压表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 配制1.000mol/LNaCl | NaCl | 容量瓶、烧杯、玻璃棒、试剂瓶 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠 | 大小试管、酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究某金属M的性质进行了如下实验,实验过程及现象如图所示。结合实验现象判断,该同学得出的下列结论中正确的是![]()
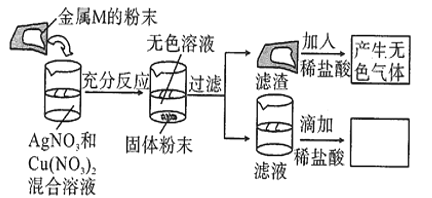
A.加入的金属M可能是铁
B.向滤液中滴加盐酸的实验现象是产生白色沉淀
C.向充分反应后未过滤的混合物中加入稀盐酸,产生的无色气体一定是![]()
D.滤渣中一定含有金属M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是元素周期表的一部分,根据①~⑩在周期表中的位置按题目要求回答:
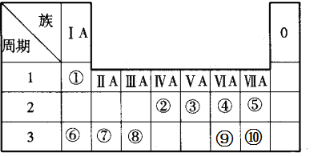
(1)在元素①~⑩中,非金属性最强的元素是__(填元素名称)。
(2)在元素⑥~⑩中,离子半径最小的元素的离子结构示意图为__。
(3)元素⑥⑦⑧的最高价氧化物对应的水化物,按碱性从强到弱的顺序排列是__(用化学式表示)。
(4)用电子式表示元素①和③形成的化合物甲的形成过程__。
(5)为验证ⅦA族部分元素非金属性的递变规律,设计了如图所示装置进行实验,请回答:

①实验室制取单质⑩的化学反应方程式__。
②A中发生反应的离子方程式是__。
③棉花中浸有的NaOH溶液的作用是(用离子方程式表示)__。
④为验证溴与碘非金属性强弱:通入一定量⑩的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到__。
⑤通过此实验,某同学得到结论:“溴比碘非金属性强”,这一说法是否正确,请说明理由___。
⑥化合物乙、丙均由①④⑥⑨四种元素组成,请写出乙与丙发生反应的离子反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+ Y(g) ![]() 2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
A. 平衡时,X 的转化率为50%
B. 该温度下平衡常数K=10
C. 10min内生成物Z 的反应速率0.2mol·L-1 ·min-1
D. 某一时刻,X、Y、Z的物质的量分别是0.4mol、0.2mol、1.6mol,此刻V正<V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B. 2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试判断下列分子中心原子的杂化类型和分子构型。
(1)NI3:______;
(2)CH3Cl:______;
(3)CO2:______;
(4)BF3:______;
(5)H2O:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中发生反应NH2COONH4(s)2NH3(g)+CO2(g),不能判断该反应已达到化学平衡的是( )
A. v正(NH3)=2v逆(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中总压强不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com