
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
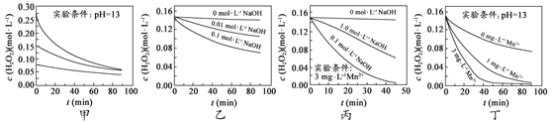
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
【答案】D
【解析】
A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此可知:在相同pH条件下,双氧水浓度越大,双氧水分解速率越快,A错误;
B.图乙中H2O2浓度相同,但加入NaOH浓度不同,说明溶液的pH不同,NaOH浓度越大,相同时间内双氧水浓度变化量越大,由此得出:当双氧水浓度相同时,溶液的pH越大,双氧水分解速率越快,B错误;
C.图丙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,C错误;
D.图丁中溶液的pH相同,Mn2+浓度越大,相同时间内双氧水浓度变化量越大,图丙中说明催化剂的催化效率受溶液的pH值影响,由此得出:碱性溶液中,Mn2+对H2O2分解速率的影响大,D正确;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 mol碳正离子(CH3+)所含的电子总数为9NA
B.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
C.标准状况下,22.4 L己烷中共价键数目为19NA
D.1 mol雄黄(As4S4),结构如图: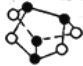 ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为________;
② Fe的基态原子共有______种不同能级的电子;
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是_______;
② COCl2分子中σ键和π键的个数比为______,中心原子的杂化方式为_______;
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO_______(填“>”、“<”或“=”)FeO。
(4)铁的某种单质的晶胞为面心立方结构,原子的配位数为_______,若铁原子半径为a nm,则该单质的密度为_______g/cm3;
(5)Fe2O3与KNO3和KOH固体高温加热可制备一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),其中KNO3被还原为KNO2,写出该反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备水合肼(N2H4·H2O)的反应原理是CO(NH2)2+ 2NaOH + NaClO=Na2CO3+N2H4·H2O+NaCl。已知CO(NH2)2沸点:133 ℃;水合肼是重要化工原料,沸点:118 ℃,易被氧化。请按要求回答下列制备水合肼实验的有关问题。
(1)制备 NaClO 溶液(实验装置如图所示)

锥形瓶中发生反应离子方程式是__________________________。
(2)制取水合肼(实验装置如右图所示,夹持装置已略)
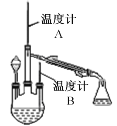
控制反应温度,再将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,加热蒸馏三颈烧瓶内的溶液,收集产品。
①分液漏斗中盛装的药品是NaOH溶液和_______________。
这样盛放的理由是防止___________________________________。
②本实验收集产品馏分时的关键条件是控制_______________________________。
(3)测定馏分中肼的含量。
①已知水合肼在一定条件下与I2反应生成N2,完成该反应原理的化学方程式:
____N2H4·H2O +____ I2 +6NaHCO3+H2SO4 = ____ N2↑+____ NaI +6CO2↑+Na2SO4 +7H2O
__________________________
②测定实验的步骤如下:
a.称取馏分 5.000 g,加水配制成1000 mL待测液溶液。
b.移取10.00 mL于锥形瓶中,加入10 mL水、稀硫酸、适量 NaHCO3固体(保证滴定过程中溶液的 pH 保持在 6.5左右)、2滴淀粉溶液,摇匀。
c.用0.2000 mol/L I2溶液滴定,至溶液呈现___________________________,记录消耗I2标准液的体积。
d._______________________________;然后处理数据。
③经数据处理,滴定消耗I2的标准溶液为 8.20 mL,馏分中水合肼(N2H4·H2O)的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是

A. δFe晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个
B. 晶体的空间利用率:δFe > γFe> αFe
C. 设γFe晶胞中铁原子的半径为d,则γFe晶胞的体积是16![]() d 3
d 3
D. 已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1),δFe晶胞的密度为ρ g/cm3,则铁原子的半径r(cm)=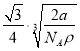
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是 ( )

A. 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B. 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C. 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D. 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到目的的是( )

A. 装置①:制取乙炔并验证炔烃的性质B. 装置②:检验乙醇的还原性,溶液颜色从橙色变成绿色
C. 装置③:验证葡萄糖分子中含有醛基官能团D. 装置④:酸性KMnO4溶液中出现气泡且颜色逐渐褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com