
ЁОЬтФПЁПжЦБИЫЎКЯыТЃЈN2H4ЁЄH2OЃЉЕФЗДгІдРэЪЧCO(NH2)2+ 2NaOH + NaClO=Na2CO3+N2H4ЁЄH2O+NaClЁЃвбжЊCO(NH2)2ЗаЕуЃК133 ЁцЃЛЫЎКЯыТЪЧживЊЛЏЙЄдСЯЃЌЗаЕуЃК118 ЁцЃЌвзБЛбѕЛЏЁЃЧыАДвЊЧѓЛиД№ЯТСажЦБИЫЎКЯыТЪЕбщЕФгаЙиЮЪЬтЁЃ
ЃЈ1ЃЉжЦБИ NaClO ШмвКЃЈЪЕбщзАжУШчЭМЫљЪОЃЉ

зЖаЮЦПжаЗЂЩњЗДгІРызгЗНГЬЪНЪЧ__________________________ЁЃ
ЃЈ2ЃЉжЦШЁЫЎКЯыТЃЈЪЕбщзАжУШчгвЭМЫљЪОЃЌМаГжзАжУвбТдЃЉ
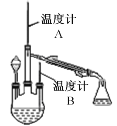
ПижЦЗДгІЮТЖШЃЌдйНЋЗжвКТЉЖЗжаШмвКЛКТ§ЕЮШыШ§ОБЩеЦПжаЃЌГфЗжЗДгІКѓЃЌМгШШеєСѓШ§ОБЩеЦПФкЕФШмвКЃЌЪеМЏВњЦЗЁЃ
ЂйЗжвКТЉЖЗжаЪЂзАЕФвЉЦЗЪЧNaOHШмвККЭ_______________ЁЃ
етбљЪЂЗХЕФРэгЩЪЧЗРжЙ___________________________________ЁЃ
ЂкБОЪЕбщЪеМЏВњЦЗСѓЗжЪБЕФЙиМќЬѕМўЪЧПижЦ_______________________________ЁЃ
ЃЈ3ЃЉВтЖЈСѓЗжжаыТЕФКЌСПЁЃ
ЂйвбжЊЫЎКЯыТдквЛЖЈЬѕМўЯТгыI2ЗДгІЩњГЩN2ЃЌЭъГЩИУЗДгІдРэЕФЛЏбЇЗНГЬЪНЃК
____N2H4ЁЄH2O +____ I2 +6NaHCO3+H2SO4 = ____ N2Ёќ+____ NaI +6CO2Ёќ+Na2SO4 +7H2O
__________________________
ЂкВтЖЈЪЕбщЕФВНжшШчЯТЃК
aЃЎГЦШЁСѓЗж 5.000 gЃЌМгЫЎХфжЦГЩ1000 mLД§ВтвКШмвКЁЃ
bЃЎвЦШЁ10.00 mLгкзЖаЮЦПжаЃЌМгШы10 mLЫЎЁЂЯЁСђЫсЁЂЪЪСП NaHCO3ЙЬЬхЃЈБЃжЄЕЮЖЈЙ§ГЬжаШмвКЕФ pH БЃГждк 6.5зѓгвЃЉЁЂ2ЕЮЕэЗлШмвКЃЌвЁдШЁЃ
cЃЎгУ0.2000 mol/L I2ШмвКЕЮЖЈЃЌжСШмвКГЪЯж___________________________ЃЌМЧТМЯћКФI2БъзМвКЕФЬхЛ§ЁЃ
dЃЎ_______________________________ЃЛШЛКѓДІРэЪ§ОнЁЃ
ЂлОЪ§ОнДІРэЃЌЕЮЖЈЯћКФI2ЕФБъзМШмвКЮЊ 8.20 mLЃЌСѓЗжжаЫЎКЯыТЃЈN2H4ЁЄH2OЃЉЕФжЪСПЗжЪ§ЮЊ____________ЁЃ
ЁОД№АИЁПCl2 +2OH-= ClO-+Cl-+ H2O NaClOШмвК ЩњГЩЕФЫЎКЯыТЛсБЛЮДЗДгІЕФДЮТШЫсФЦбѕЛЏ ЮТЖШМЦAЮЊ118 Ёц 1 2 1 4 РЖЩЋЧвАыЗжжгВЛЯћЪЇ жиИДЩЯЪіbЁЂcВНжшЪЕбщВйзї2~3ДЮ 82.00%
ЁОНтЮіЁП
ЃЈ1ЃЉЯђNaOHШмвКжаЭЈШыCl2ПЩжЦЕУNaClOЃЌРызгЗНГЬЪНЮЊЃКCl2+2OH-=ClO-+Cl-+H2OЃЛ
ЃЈ2ЃЉЂйЗжвКТЉЖЗжаЪЂЗХNaOHШмвККЭNaClOШмвКЃЌШєНЋNaClOжБНгЗХдкШ§ОБЩеЦПжаЃЌNaClOПЩНЋЗДгІЩњГЩЕФЫЎКЯыТжБНгбѕЛЏЃЌгАЯьВњТЪЃЛ
ЂквђЮЊЫЎКЯыТЕФЗаЕуЮЊ118ЁцЃЌЙЪашвЊПижЦЬхЯЕЮТЖШжС118ЁцЃЌвдЗРжЙЦфЫћЮяжЪеєГіЃЌПижЦеєСѓЕФЮТЖШгІНЋЮТЖШМЦЕФЫЎвјЧђЗХдкеєСѓЩеЦПжЇЙмПкГіЃЌБЃжЄеєГіЦјЬхЕФЮТЖШКуЖЈЃЛ
ЃЈ3ЃЉЂйЭъећЕФЛЏбЇЗНГЬЪНЮЊN2H4ЁЄH2O+2I2+6NaHCO3+H2SO4=N2Ёќ+4NaI+6CO2Ёќ+Na2SO4+7H2OЃЛ
ЂкЕБЬхЯЕбеЩЋГЪРЖЩЋЧвАыЗжжгФкВЛЭЪЩЋЪБЃЌЫЕУїЕЮЖЈДяЕНСЫжеЕуЃЛЮЊМѕаЁЪЕбщЮѓВюЃЌашвЊжиИДЪЕбщ2-3ДЮЃЛ
ЂлИљОнЗНГЬЪНПЩжЊзЖаЮЦПжа![]() =
=![]() =0.041mol/LЃЌЙЪД§ВтвКжаc(N2H4ЁЄH2O)=0.082mol/LЃЌm(N2H4ЁЄH2O)=0.082
=0.041mol/LЃЌЙЪД§ВтвКжаc(N2H4ЁЄH2O)=0.082mol/LЃЌm(N2H4ЁЄH2O)=0.082![]() 50=4.10gЃЌдђСѓЗжжаЫЎКЯыТЕФжЪСПЗжЪ§ЮЊ
50=4.10gЃЌдђСѓЗжжаЫЎКЯыТЕФжЪСПЗжЪ§ЮЊ![]() =82.00%ЁЃ
=82.00%ЁЃ


 УћаЃСЊУЫПьРжПЮЬУЯЕСаД№АИ
УћаЃСЊУЫПьРжПЮЬУЯЕСаД№АИ ЛЦИдДДгХОэЯЕСаД№АИ
ЛЦИдДДгХОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯВЩгУСђЬњПѓБКЩеЕФЩедќ(жївЊГЩЗжЮЊFe2O3ЁЂSiO2ЃЌВЛПМТЧЦфЫћдгжЪ)жЦШЁТЬЗЏ(FeSO4ЁЄ7H2O)ЃЌСїГЬШчЭМЃК
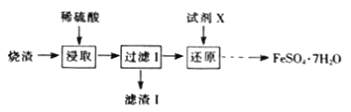
ЃЈ1ЃЉТЫдќЂёЕФжївЊГЩЗжЪЧ___(ЬюЛЏбЇЪН)ЁЃ
ЃЈ2ЃЉЛЙдЪБЃЌЪдМСXШєбЁгУSO2ЃЌЦфЗДгІКѓЩњГЩЕФвѕРызгЪЧ(ЬюЛЏбЇЪН)___ЁЃ
ЃЈ3ЃЉДгЛЙдКѓЕФШмвКжаЕУЕНВњЦЗЃЌгІНјааЕФВйзїЪЧ___ЁЂ___ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЃ
ЃЈ4ЃЉТЬЗЏ(FeSO4ЁЄ7H2O)дквНбЇЩЯГЃгУзїВЙбЊМСЁЃФГПЮЭтаЁзщЭЈЙ§вдЯТЪЕбщЗНЗЈВтЖЈФГВЙбЊМСжабЧЬњРызгЕФКЌСПЁЃ
ВНжшaЃКШЁ10ЦЌВЙбЊМСбљЦЗГ§ШЅЬЧвТЁЂбаФЅЁЂШмНтЁЂЙ§ТЫЃЌНЋТЫвКХфГЩ250.00mLШмвКЃЛ
ВНжшbЃКШЁЩЯЪіШмвК25.00mLгкзЖаЮЦПжаЃЌМгШыЩйСПЯЁСђЫсЫсЛЏКѓЃЌж№НЅЕЮМг0.1000mol/LЕФKMnO4ШмвКЃЌжСЧЁКУЭъШЋЗДгІЃЌМЧТМЯћКФЕФKMnO4ШмвКЕФЬхЛ§(МйЖЈвЉЦЗжаЦфЫћГЩЗжВЛгыKMnO4ЗДгІ)ЃЌЗЂЩњЕФЗДгІЮЊЃКMnO4-+5Fe2++8H+=5Fe3++Mn2++4H2OЃЛ
ВНжшcЃКжиИДЁАВНжшbЁБ2~3ДЮЃЌЦНОљЯћКФKMnO4ШмвК20.00mLЁЃИУВЙбЊМСжабЧЬњРызгЕФКЌСПЮЊ___mg/ЦЌЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЮяHЃЈ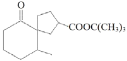 ЃЉЪЧвЛжжгУгкКЯГЩНЁЦЂЃЌьюЗчЃЌЩЂКЎвЉЮяЕФжаМфЬхЃЌЦфКЯГЩТЗЯпШчЯТЃК
ЃЉЪЧвЛжжгУгкКЯГЩНЁЦЂЃЌьюЗчЃЌЩЂКЎвЉЮяЕФжаМфЬхЃЌЦфКЯГЩТЗЯпШчЯТЃК

вбжЊЃКЂй![]()
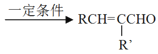 +H2OЃЈRЃЌ
+H2OЃЈRЃЌ![]() ЪЧHЛђЬўЛљЃЉ
ЪЧHЛђЬўЛљЃЉ
Ђк![]()
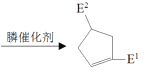 ЃЈ
ЃЈ![]() ПЩвдЪЧ
ПЩвдЪЧ![]() Лђ
Лђ![]() ЃЉ
ЃЉ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAКЌгаЕФЙйФмЭХЪЧ__________________________________ЃЛ
ЃЈ2ЃЉBЕФНсЙЙМђЪНЮЊ__________________________________ЃЛ
ЃЈ3ЃЉНЋЯТСаBЁњCЕФЖрВНЗДгІСїГЬЭМВЙГфЭъећЃЈБъУїЗДгІЬѕМўЃЉЃК
_____________________________________________ЃЛ
ЃЈ4ЃЉгЩCКЭDЩњГЩEЕФЛЏбЇЗНГЬЪНЮЊ_______________________________________ЃЛ
ЃЈ5ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧ_______________________ЃЛ
aЃЎЮяжЪDЕФКЫДХЙВеёЧтЦзга2зщЮќЪеЗхЃЛ
bЃЎЮяжЪFПЩгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЃЛ
cЃЎGЁњHЕФЗДгІЮЊМгГЩЗДгІЃЛ
ЃЈ6ЃЉEКЭFЗДгІЩњГЩGЕФЛЏбЇЗНГЬЪНЮЊ________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЭМжаЕФЪЕбщЗНАИЃЌВЛФмДяЕНЯргІЪЕбщФПЕФЪЧ
A.ЖдИжЬњеЂУХЗРИЏБЃЛЄ
B.Г§ШЅCO2ЦјЬхжаЛьгаЕФSO2
C.бщжЄCH3CH2BrгыNaOHввДМШмвКЙВШШВњЮягаввЯЉЩњГЩ
D.бщжЄCuSO4ЖдH2O2ЗжНтЗДгІгаДпЛЏзїгУ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкввШВЗжзгжаЕФЙВМлМќЫЕЗЈе§ШЗЕФЪЧ
A. spдгЛЏЙьЕРаЮГЩІвМќЪєгкМЋадМќЃЌЮДдгЛЏЕФ2pЙьЕРаЮГЩІаМќЪєгкЗЧМЋадМќ
B. CЃHжЎМфЪЧspЃsаЮГЩІвМќЃЌгыsЃp ІвМќЕФЖдГЦадВЛЭЌ
C. (CN)2гыввШВЖМЪєгкжБЯпаЭЗжзгЃЌЫљвд(CN)2ЗжзгжаКЌга3ИіІвМќКЭ2ИіІаМќ
D. гЩгкІаМќЕФМќФмБШІвМќЕФМќФмаЁЃЌввШВЗжзг![]() Ш§МќЕФМќФмаЁгкCЃCЕЅМќЕФМќФмЕФ3БЖЃЌЫљвдввШВЛЏбЇаджЪЛюЦУвзгкЗЂЩњМгГЩЗДгІ
Ш§МќЕФМќФмаЁгкCЃCЕЅМќЕФМќФмЕФ3БЖЃЌЫљвдввШВЛЏбЇаджЪЛюЦУвзгкЗЂЩњМгГЩЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПH2O2ЗжНтЫйТЪЪмЖржжвђЫигАЯьЁЃЪЕбщВтЕУ 70 ЁцЪБВЛЭЌЬѕМўЯТH2O2ХЈЖШЫцЪБМфЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
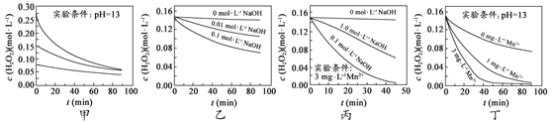
A.ЭММзБэУїЃЌЦфЫћЬѕМўЯрЭЌЪБЃЌH2O2ХЈЖШдНаЁЃЌЦфЗжНтЫйТЪдНПь
B.ЭМввБэУїЃЌЦфЫћЬѕМўЯрЭЌЪБЃЌШмвКpHдНаЁЃЌH2O2ЗжНтЫйТЪдНПь
C.ЭМБћБэУїЃЌЩйСПMn 2+ДцдкЪБЃЌШмвКМюаддНЧПЃЌH2O2ЗжНтЫйТЪдНПь
D.ЭМБћКЭЭМЖЁБэУїЃЌМюадШмвКжаЃЌMn2+ЖдH2O2ЗжНтЫйТЪЕФгАЯьДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИпЮТЯТЃЌГЌбѕЛЏМиОЇЬхГЪСЂЗНЬхНсЙЙЃЌОЇЬхжабѕЕФЛЏКЯМлВПЗжЮЊ0МлЃЌВПЗжЮЊЃ2МлЃЌШчЭМЫљЪОЮЊГЌбѕЛЏМиОЇЬхЕФвЛИіОЇАћЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
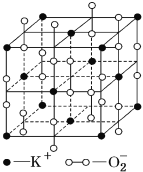
A. ГЌбѕЛЏМиЕФЛЏбЇЪНЮЊKO2ЃЌУПИіОЇАћКЌга4ИіKЃЋКЭ4Иі![]()
B. ОЇЬхжаУПИіKЃЋжмЮЇга8Иі![]() ЃЌУПИі
ЃЌУПИі![]() жмЮЇга8ИіKЃЋ
жмЮЇга8ИіKЃЋ
C. ОЇЬхжагыУПИіKЃЋОрРызюНќЕФKЃЋга8ИіЃЌОЇЬхжагыУПИі![]() ОрРызюНќЕФ
ОрРызюНќЕФ![]() га6Иі
га6Иі
D. ОЇЬхжаЦфжа0МлбѕКЭЃ2МлбѕЕФЮяжЪЕФСПжЎБШЮЊ1:1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЋЙЬЬЌяЎСђЕчГиФмСПУмЖШИпЁЂГЩБОЕЭЃЌЦфЙЄзїдРэШчЭМЫљЪОЃЌЦфжаЕчМЋ aГЃгУВєгаЪЏФЋЯЉЕФS8ВФСЯЃЌЕчГиЗДгІЮЊЃК16Li+xS8=8Li2SxЃЈ2ЁмxЁм8ЃЉЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ

A. ЕчГиЙЄзїЪБЃЌе§МЋПЩЗЂЩњЗДгІЃК2Li2S6+2Li++2e-=3Li2S4
B. ЕчГиЙЄзїЪБЃЌЭтЕчТЗжаСїЙ§ 0.02 mol ЕчзгЃЌИКМЋВФСЯМѕжи 0.14 g
C. ЪЏФЋЯЉЕФзїгУжївЊЪЧЬсИпЕчМЋaЕФЕМЕчад
D. ЕчГиГфЕчЪБМфдНГЄЃЌЕчГижаLi2S2ЕФСПдНЖр
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввѕЃЫЎбюЫсЃЈАЂЫОЦЅСжЃЉЪЧФПЧАГЃгУвЉЮяжЎвЛЁЃЪЕбщЪвЭЈЙ§ЫЎбюЫсНјааввѕЃЛЏжЦБИАЂЫОЦЅСжЕФвЛжжЗНЗЈШчЯТЃК

ЫЎбюЫс | ДзЫсєћ | ввѕЃЫЎбюЫс | |
ШлЕу/Ёц | 157~159 | -72~-74 | 135~138 |
ЯрЖдУмЖШ/ЃЈgЁЄcmЉ3ЃЉ | 1.44 | 1.10 | 1.35 |
ЯрЖдЗжзгжЪСП | 138 | 102 | 180 |
ЪЕбщЙ§ГЬЃКдк100 mLзЖаЮЦПжаМгШыЫЎбюЫс6.9 gМАДзЫсєћ10 mLЃЌГфЗжвЁЖЏЪЙЙЬЬхЭъШЋШмНтЁЃЛКТ§ЕЮМг0.5 mLХЈСђЫсКѓМгШШЃЌЮЌГжЦПФкЮТЖШдк70 ЁцзѓгвЃЌГфЗжЗДгІЁЃЩдРфКѓНјааШчЯТВйзї.
ЂйдкВЛЖЯНСАшЯТНЋЗДгІКѓЕФЛьКЯЮяЕЙШы100 mLРфЫЎжаЃЌЮіГіЙЬЬхЃЌЙ§ТЫЁЃ
ЂкЫљЕУНсОЇДжЦЗМгШы50 mLБЅКЭЬМЫсЧтФЦШмвКЃЌШмНтЁЂЙ§ТЫЁЃ
ЂлТЫвКгУХЈбЮЫсЫсЛЏКѓРфШДЁЂЙ§ТЫЕУЙЬЬхЁЃ
ЂмЙЬЬхОДПЛЏЕУАзЩЋЕФввѕЃЫЎбюЫсОЇЬх5.4 gЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉИУКЯГЩЗДгІжагІВЩгУ__________МгШШЁЃЃЈЬюБъКХЃЉ
AЃЎШШЫЎдЁ BЃЎОЦОЋЕЦ CЃЎУКЦјЕЦ DЃЎЕчТЏ
ЃЈ2ЃЉЯТСаВЃСЇвЧЦїжаЃЌЂйжаашЪЙгУЕФга________ЃЈЬюБъКХЃЉЃЌВЛашЪЙгУЕФ_______________________ЃЈЬюУћГЦЃЉЁЃ

ЃЈ3ЃЉЂйжаашЪЙгУРфЫЎЃЌФПЕФЪЧ______________________________________ЁЃ
ЃЈ4ЃЉЂкжаБЅКЭЬМЫсЧтФЦЕФзїгУЪЧ_________________________________ЃЌвдБуЙ§ТЫГ§ШЅФбШмдгжЪЁЃ
ЃЈ5ЃЉЂмВЩгУЕФДПЛЏЗНЗЈЮЊ____________ЁЃ
ЃЈ6ЃЉБОЪЕбщЕФВњТЪЪЧ_________%ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com