
����Ŀ������ˮ���ᣨ��˾ƥ�֣���Ŀǰ����ҩ��֮һ��ʵ����ͨ��ˮ��������������Ʊ���˾ƥ�ֵ�һ�ַ������£�

ˮ���� | ������ | ����ˮ���� | |
�۵�/�� | 157~159 | -72~-74 | 135~138 |
����ܶ�/��g��cm��3�� | 1.44 | 1.10 | 1.35 |
��Է������� | 138 | 102 | 180 |
ʵ����̣���100 mL��ƿ�м���ˮ����6.9 g��������10 mL�����ҡ��ʹ������ȫ�ܽ⡣�����μ�0.5 mLŨ�������ȣ�ά��ƿ���¶���70 �����ң���ַ�Ӧ�������������²���.
���ڲ��Ͻ����½���Ӧ��Ļ���ﵹ��100 mL��ˮ�У��������壬���ˡ�
�����ýᾧ��Ʒ����50 mL����̼��������Һ���ܽ⡢���ˡ�
����Һ��Ũ�����ữ����ȴ�����˵ù��塣
�ܹ��徭�����ð�ɫ������ˮ���ᾧ��5.4 g��
�ش��������⣺
��1���úϳɷ�Ӧ��Ӧ����__________���ȡ������ţ�
A����ˮԡ B���ƾ��� C��ú���� D����¯
��2�����в��������У�������ʹ�õ���________�����ţ�������ʹ�õ�_______________________�������ƣ���

��3��������ʹ����ˮ��Ŀ����______________________________________��
��4�����б���̼�����Ƶ�������_________________________________���Ա���˳�ȥ�������ʡ�
��5���ܲ��õĴ�������Ϊ____________��
��6����ʵ��IJ�����_________%��
���𰸡�A BD ��Һ©��������ƿ �����������ˮ������壨�ᾧ�� ���ɿ��ܵ�����ˮ������ �ؽᾧ 60
��������
��1����Ϊ��Ӧ�¶���70��������ˮ�ķе㣬����ά�¶Ȳ��䣬�ʲ�����ˮԡ�ķ������ȣ�
��2���������轫��Ӧ�ﵹ����ˮ����Ҫ���ձ���ȡ�ʹ����ˮ�����˵IJ����л���Ҫ©�������Ϊ��B��D����Һ©����Ҫ���ڷ��뻥�����ݵ�Һ���������ƿ��������һ��Ũ�ȵ���Һ�������������ò�����
��3����Ӧʱ�¶Ƚϸߣ���������ˮ��Ŀ����ʹ������ˮ���ᾧ����������
��4������ˮ����������ˮ��Ϊ�˳�ȥ���е����ʣ��ɽ����ɵ�����ˮ������̼�����Ʒ�Ӧ���ɿ����Ե�����ˮ�����ƣ��Ա���˳�ȥ���ʣ�
��5��ÿ�νᾧ�����л�����������һ������������ͨ����νᾧ�ķ������д�����Ҳ�����ؽᾧ��
��6��ˮ�������ʽΪC7H6O3������ˮ�������ʽΪC9H8O4�����ݹ�ϵʽ������ã�
C7H6O3~ C9H8O4
138 180
6.9g m
m( C9H8O4)=(6.9g��180)/138=9g�������Ϊ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�ˮ���£�N2H4��H2O���ķ�Ӧԭ����CO(NH2)2+ 2NaOH + NaClO=Na2CO3+N2H4��H2O+NaCl����֪CO(NH2)2�е㣺133 ����ˮ��������Ҫ����ԭ�ϣ��е㣺118 �����ױ��������밴Ҫ��ش������Ʊ�ˮ����ʵ����й����⡣
��1���Ʊ� NaClO ��Һ��ʵ��װ����ͼ��ʾ��

��ƿ�з�����Ӧ���ӷ���ʽ��__________________________��
��2����ȡˮ���£�ʵ��װ������ͼ��ʾ���г�װ�����ԣ�
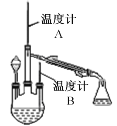
���Ʒ�Ӧ�¶ȣ��ٽ���Һ©������Һ��������������ƿ�У���ַ�Ӧ��������������ƿ�ڵ���Һ���ռ���Ʒ��
����Һ©����ʢװ��ҩƷ��NaOH��Һ��_______________��
����ʢ�ŵ������Ƿ�ֹ___________________________________��
����ʵ���ռ���Ʒ���ʱ�Ĺؼ������ǿ���_______________________________��
��3���ⶨ������µĺ�����
����֪ˮ������һ����������I2��Ӧ����N2����ɸ÷�Ӧԭ���Ļ�ѧ����ʽ��
____N2H4��H2O +____ I2 +6NaHCO3+H2SO4 = ____ N2��+____ NaI +6CO2��+Na2SO4 +7H2O
__________________________
���ⶨʵ��IJ������£�
a����ȡ��� 5.000 g����ˮ���Ƴ�1000 mL����Һ��Һ��
b����ȡ10.00 mL����ƿ�У�����10 mLˮ��ϡ���ᡢ���� NaHCO3���壨��֤�ζ���������Һ�� pH ������ 6.5���ң���2�ε�����Һ��ҡ�ȡ�
c����0.2000 mol/L I2��Һ�ζ�������Һ����___________________________����¼����I2��Һ�������
d��_______________________________��Ȼ�������ݡ�
�������ݴ������ζ�����I2�ı���ҺΪ 8.20 mL�������ˮ���£�N2H4��H2O������������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܽ����ˮ��H2�����������������ܴ������߹��ˮ��H2��Ч�ʣ������ѳ�SO2������ԭ������ͼ��ʾ������˵������ȷ����
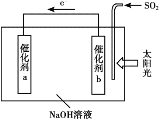
A. ��װ�ÿɽ�̫����ת��Ϊ��ѧ��
B. ����b��������ҺpH����
C. ����1mol SO2���������ܲ���1mol H2
D. ����a���淢���ķ�ӦΪ��2H2O��2e��=H2����2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭþ�Ͻ�1.52g��ȫ�ܽ���50mL�ܶ�Ϊ1.40g��mL-1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL(��״��)����Ӧ�����Һ�м���1.0mol��L-1NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ���ǣ� ��
A.�úϽ���ͭ��þ�����ʵ���֮����2��1
B.�õ�2.54g����ʱ������NaOH��Һ�������600mL
C.��Ũ������HNO3�����ʵ���Ũ����14.0mol��L-1
D.NO2��N2O4�Ļ�������У�NO2�����������80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������ѭ��Ч�ʺ��ȶ��ԣ���ѧ�ҽ���������ά�����״Zn��3DZn�����Ը�Ч����ZnO���ص㣬����˲���ǿ���Ե���ʵ�3DZn��NiOOH���ε�أ��ṹ����ͼ��ʾ����ط�ӦΪZn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)��
ZnO(s)+2Ni(OH)2(s)��

A. ��ά�����״Zn���нϸߵı��������������ZnO��ɢ�ȸ�
B. ���ʱ������ӦΪNi(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. �ŵ�ʱ������ӦΪZn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. �ŵ������OHͨ����Ĥ�Ӹ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û�������ܴﵽĿ�ĵ���( )

A. װ�â٣���ȡ��Ȳ����֤Ȳ��������B. װ�âڣ������Ҵ��Ļ�ԭ�ԣ���Һ��ɫ�ӳ�ɫ�����ɫ
C. װ�âۣ���֤�����Ƿ����к���ȩ��������D. װ�âܣ�����KMnO4��Һ�г�����������ɫ����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ�����CaCO3�㷺Ӧ���������ϡ��������ҵ��һ������ʯ��(��Ҫ�ɷ�ΪCaSO4��������SiO2��Al2O3)Ϊԭ���Ʊ����ʸߴ�CaCO3��������ͼ��

����˵��������ǣ� ��
A.��ת����ʱ������Ӧ�����ӷ���ʽΪCaSO4+2NH3+CO2+H2O=CaCO3+2NH4++SO42-
B.��ת����ʱӦ��ͨ��CO2����ͨ��NH3
C.ʵ������������ʱ�õ��IJ��������в�������©�����ձ�
D.����ȡ�������л���NH3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֳ������ʵ�ת����ϵ��ͼ��ʾ(���ַ�Ӧ�P������ȥ)������W��M��X����ij����ͬ��Ԫ�ء�����˵��������ǣ� ��

A.��XΪO2����W����Ϊ������̼
B.��XΪAl(OH)3����Y����Ϊϡ����
C.��XΪFe����Y����Ϊϡ����
D.��XΪNaHCO3����M����Ϊ������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������۱���ϩ���������£�������������ȷ��

A.�ұ��ķ���ʽΪC8H10B.�۱���ϩ���ڸ߷��ӻ�����
C.lmol����ϩ������3mol H2�����ӳɷ�ӦD.�����뱽��ϩ��������KMnO4��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com