
| A.Cl->Fe2+>I- | B.Fe2+>I->Cl- |
| C.I->Fe2+>Cl- | D.Fe2+>Cl->I- |
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).

| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
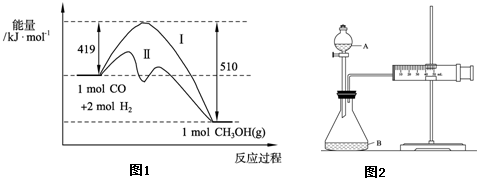
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
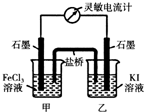
查看答案和解析>>
科目:高中化学 来源:高考总复习全解 化学 一轮复习·必修课程 (人教实验版) 人教实验版 题型:022
已知2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________.
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________.
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-恰好完全被氧化时,c为________(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源:湖南省永州市四中2006-2007届高三化学第一次月考试卷 题型:022
I.(1)请将反应物的化学式及配平后的系数填入下列相应的位置中:
FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O↑+________
(2)反应物中发生还原反应的物质________,被还原的元素是________.
(3)反应中1mol还原剂________(填“得到”或“失去”)________mol电子.
II.已知2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-
(1)若向FeI2和FeBr2混合液中通入过量氯气,写出可能发生的离子方程式________.
(2)若向含amolFeI2和bmolFeBr2混合液中通入cmol氯气,当I-、Fe2+、Br-完全被氧化时,c为________mol(用含a,b的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com