
����Ŀ����14�֣���ҵ�ϳ����մ��սᷨ��ȡ��Ȼ���е�ϡɢԪ����(Se)���ҹ�������Ա������Ƶ����ô�ͭ��⾫����������������ͭ(Cu2Se)���ڻ���ͭ(Cu2Te)��������Ϊԭ�ϣ���ȡ����ij�ֹ���������ͼ��ʾ��
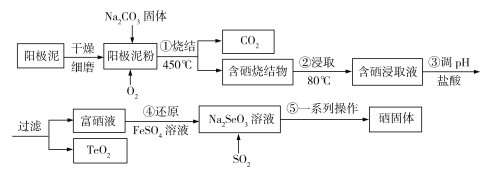
�ش��������⣺
��1����⾫��ͭʱ����Դ����������_______��������ͭ��������ͭ�����������ܽ�ͭ������__________������������=��������������������ͭ��������
��2�����ս���ʱ�մ��������ͭ��Ҫ������Na2SeO3��Cu2O��CO2���壬�÷�Ӧ�Ļ�ѧ����ʽΪ________________________________�����ս���ʱ�������ٲ���Na2SeO4��д������ԭ��ʱ��Ӧ�����ӷ���ʽ____________��
��3�������ս����ȡʱ����Ѽ��ȷ�ʽΪ________________����ȥ������Ϊ___________���ѧʽ����
��4�������ո�����TeO2����������������������������ϣ�������ǿ���ǿ����γɸ��Σ���TeO2����______�������������������������������������
��5�������Ṥҵ��һ���IJ���SO2ͨ��Na2SeO3��Һ�Ʊ������ʣ�д���÷�Ӧ�����ӷ���ʽ___________________�����õ�50 kg�����ʣ�������Ҫ___________kg��������Ϊ90%��FeS2��ʯ�����������һλС����
���𰸡���ͭ �� 2Cu2Se��2Na2CO3��3O2![]() 2Cu2O��2Na2SeO3��2CO2 2Fe2+��
2Cu2O��2Na2SeO3��2CO2 2Fe2+��![]() ��2H+===2Fe3+��
��2H+===2Fe3+��![]() ��H2O ˮԡ���� Cu2O ����
��H2O ˮԡ���� Cu2O ���� ![]() +H2O+2SO2===Se��+2
+H2O+2SO2===Se��+2![]() +2H+ 84.4
+2H+ 84.4
��������
��1����⾫��ͭʱ����ͭ���ӵ�Դ����������ͭ���ӵ�Դ�ĸ���������ͭ�ܽ�ŵ��ͬʱ������п���������Ƚ���ͬʱ�ŵ磬����ֻ��ͭ����������ת�Ƶ�������ͬ�����ԣ������ܽ�ͭ������С����������ͭ��������
��2��������Ϣ��Cu2Se��+1��ͭԪ�ػ��ϼ�δ�䣬2����Ԫ�ػ��ϼ�������+4�ۣ����ϼ�������6��O2����ԭΪ2��O�����ϼ۽�����4�����û��ϼ���������ƽ���ɵó���Ӧ�Ļ�ѧ����ʽ��2Cu2Se��2Na2CO3��3O2![]() 2Cu2O��2Na2SeO3��2CO2��
2Cu2O��2Na2SeO3��2CO2��
��3������ȡ��ʱ�¶�Ϊ80 ����ˮԡ�����¶��ȶ��������ƣ�������Ѽ��ȷ�ʽΪˮԡ���ȣ��ӣ�2����ķ���ʽ��֪��������Cu2O������ˮ������ȡ��ʱ��ȥ������ΪCu2O��TeO2��ǿ���ǿ����ܷ�Ӧ����TeO2�������������
��4��Fe2+������ΪFe3+���ϼ�������1��![]() ת��Ϊ
ת��Ϊ![]() ��SeԪ�ػ��ϼ۽�����2�����û��ϼ���������ƽ���ɵó���Ӧ�����ӷ���ʽ��2Fe2+��
��SeԪ�ػ��ϼ۽�����2�����û��ϼ���������ƽ���ɵó���Ӧ�����ӷ���ʽ��2Fe2+��![]() ��2H+===2Fe3+��
��2H+===2Fe3+��![]() ��H2O��
��H2O��
��5��SO2ͨ��Na2SeO3��Һ�Ʊ������ʣ���Ӧ�����ӷ���ʽΪ![]() +H2O+2SO2===Se��+2
+H2O+2SO2===Se��+2![]() +2H+����֪n(SO2)��n(
+2H+����֪n(SO2)��n(![]() )��n(Se)=2��1��1��������Ԫ���غ㣬�Ƴ�n(FeS2)��n(SO2)=1��2���ۺϿɵ�n(FeS2)��n(Se)=1��1������Ҫm kg FeS2������ʽ���£�
)��n(Se)=2��1��1��������Ԫ���غ㣬�Ƴ�n(FeS2)��n(SO2)=1��2���ۺϿɵ�n(FeS2)��n(Se)=1��1������Ҫm kg FeS2������ʽ���£�
FeS2 �� Se
120 79
m kg��90% 50 kg
���m=84.4��


 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ����C(s)+O2(g)=CO2(g)��H1��
��C(s)+![]() O2(s)=CO(g)��H2��
O2(s)=CO(g)��H2��
��CO2(g)+C(s)=2CO(g)��H3��
��4Fe(s)+3O2(g)=2Fe2O3(s)��H4��
��3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)��H5
�����ж���ȷ����(����)
A.��H4��Fe��ȼ����
B.��H1>��H2
C.��H3=2��H2-��H1
D.3��H1-3��H2-![]() ��H4+��H5=0
��H4+��H5=0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��ͼ)��������������ҩ����Ұ���ܲ�����Ҷˮ�ա�������С���������ֹѪ���á����й��ڿ������˵������ȷ����
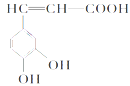
A.������ķ���ʽΪC9H8O4
B.1 mol��������Ժͺ�4 molBr2��Ũ��ˮ��Ӧ
C.1 mol������������NaHCO3��Һ��Ӧ�ܲ��������Լ67.2L��CO2
D.�������ø�����ؼ��鿧��������е�̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ��������(Cl2)���ռ�������Ļ�ѧ����ʽ�ǣ�2NaCl+2H2O![]() 2NaOH+Cl2��+H2��
2NaOH+Cl2��+H2��
��1����˫���ű�ʾ������ת�Ƶķ������Ŀ__������з�Ӧ��д�����ӷ���ʽ��___��
��2�����ʳ��ˮ�Ĺ����У�����������___��
��3�����ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+��Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ������ռ��ַ�Ӧ����ˣ�����Һ�м��������к������ԡ���������Һ��Ӧ�����ӷ���ʽ��___��___��
��4������ƽ���»�ѧ����ʽ��__Al��__NaNO3��__NaOH=__NaAlO2��__N2����__H2O������Ӧ������ת��5mol���ӣ������ɱ�״����N2�����Ϊ___L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��Ӧ�ñȽϹ㷺���Ķ�����IJ��ϣ������ػ�ѧ֪ʶ�ش��������⡣�ڻ�ҩ��Ҫ������ء���ǡ�ľ̿���߷�ĩ�Ļ����ڵ�ȼ�����£��仯ѧ��Ӧʽ��ҪΪ��2KNO3+S+3C=N2��+3CO2��+K2S
��1���ںڻ�ҩȼ�յķ�Ӧ�У�������Ϊ___��
��2���÷�Ӧ��������Ԫ����___��
��3���÷�Ӧ������������___��
��4��KNO3��NԪ�صĻ��ϼ���___��
��5�����ݻ�ѧ��Ӧʽ������һ����ԭ�Ӳ��뷴Ӧʱת��___�����ӣ�
��6����Cl2ͨ��Ũ��ˮ�У��������·�Ӧ��3Cl2+8NH3=6NH4Cl+N2����˫���ű�ʾ��Ӧ�ĵ���ת�Ʒ������Ŀ��___��
��7����֪�������з�Ӧ����ClO3-��5Cl-��6H+ =3Cl2��3H2O ��2Fe2+��Cl2=2Fe3+��2 Cl-����ClO3-��Fe3+��Cl2����������������ǿ������˳����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������(��)Һ�������(Sb2S3���뵼��)��ȡ���װ����ͼ��ʾ�� ����˵���������( )
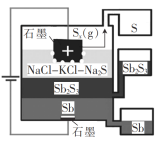
A.Sb����������
B.�������廥�����ܣ��ܶ�Ҳ��ͬ
C.�����ĵ缫��ӦʽΪxS2- - 2xe- = Sx
D.�õ��տ��������¹���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ���� H3A �ڱ�����Լ���ϴ�Ӽ������ȷ��������Ҫ�ĵ�λ������ʱ���� 10 mL 0.01 mol��L1 �� H3A ��Һ�е��� 0.01 mol��L1 �� NaOH ��Һ��H3A��H2A��HA2��A3�����ʵ�����������Һ�� pH �Ĺ�ϵ�� ͼ��ʾ������˵���������( )
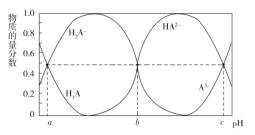
A.���¶��£�H3A �ĵ��볣�� Ka1=10a
B.�� b=7������ 20 mL NaOH ��Һʱ����Һ�� pH��7
C.NaOH ��Һ�����Ϊ 30 mL ʱ����Һ�У�c(OH)=3c(H3A)��2c(H2A)��c(HA2)��c(H+)
D.��Ӧ 2H2A![]() H3A��HA2�ڸ��¶��µ�ƽ�ⳣ��K=10a-b
H3A��HA2�ڸ��¶��µ�ƽ�ⳣ��K=10a-b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol AlCl3��Һ�м��뺬��bmol KOH��Һ�����ɳ��������ʵ���������
��amol ��bmol ��a/3mol ��b/3mol ��0 mol ��(4a-b)mol
A.�٢ۢܢݢ�B.�٢ڢۢܢ�C.�٢ܢݢ�D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3CuO+2NH3![]() 3Cu+N2+3H2O�������ж���ȷ����
3Cu+N2+3H2O�������ж���ȷ����
A.NԪ�صĻ��ϼ۽���B.NH3����ԭ
C.����0.3 mol CuOת��0.6 NA������D.CuO�ǻ�ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com