
����Ŀ��ijͬѧ�����һ���״�ȼ�ϵ�أ����øõ�ص��200mLһ��Ũ�ȵ�NaCl��CuSO4�����Һ����װ����ͼ1�� 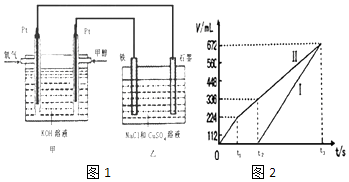
��1��д������ͨ��״���һ���ĵ缫��Ӧʽ ��
��2������������������������������ʱ��仯�Ĺ�ϵ��ͼ2��ʾ���ѻ���ɱ�״���µ��������д����t1��ʯī�缫�ϵĵ缫��Ӧʽ��ԭ�����Һ��NaCl�����ʵ���Ũ��Ϊmol/L��������Һ������䣩
��3������������װ����ͨ�����µ�����336mLʱ�������������缫�Ͽ�����ͭ������Ϊg��
��4����֪����H2C2O4Ϊ���ᣮ �ٳ����£�������ʵ��˵��������������ʵ��� ��
A�����������Һ�ӷ�̪����Һ���
B��ȡһ����������Һ��ˮϡ����10����pH�仯С��1
C��������ʹ����KMnO4��Һ��ɫ
D��ȡ��ͬpH�IJ�����Һ�����ᣬ�ֱ���������Ĵ�С����״��ͬ��þ����������Һ��Ӧ�ٶȿ�
�ڳ����£�0.1molL��1�IJ�����Һ��pH=13��NaOH��Һ�������ϣ�������Һ��pHΪ6����c��HC2O4��+2c��C2O42����=����ȷ����ѧ����ʽ��ʾ��
���𰸡�
��1��CH3OH��6e��+8OH��=CO32��+6H2O
��2��0.1
��3��1.28
��4��ABD��0.05+10��6��10��8
���������⣺��1����ȼ�ϵ�ص��У���������ȼ�Ϸ���ʧ���ӵ�������Ӧ���ڼ��Ի����£��״�ʧ���ӵĹ���Ϊ��CH3OH��6e��+8OH��=CO32��+6H2O�� ���Դ��ǣ�CH3OH��6e��+8OH��=CO32��+6H2O����2��ʯīΪ���������缫Ϊ��������ʼCl���������ŵ���������������Cu2+�ŵ�����Cu����ͼ���Т��ʾ�������������壬���ʾ�������������壬t1ǰ�缫��ӦʽΪ������2Cl����4e��=Cl2����t2���缫��ӦʽΪ������4OH����4e��=O2��+2H2O��
��ͼ��֪����������Ϊ224mL������2Cl����2e��=Cl2����֪��n��NaCl��= ![]() ��2=0.02mol������c��NaCl��=
��2=0.02mol������c��NaCl��= ![]() =0.1mol/L��
=0.1mol/L��
ͨ�״��ĵ缫�Ǹ���������ʯī�缫���������ü��Ϸ����ĵ缫��ӦΪ��4OH����4e��=O2��+2H2O������ʯī�缫Ϊ���������缫Ϊ��������ʼCl���������ŵ���������������Cu2+�ŵ�����Cu����ͼ���Т��ʾ�������������壬���ʾ�������������壬t1ǰ�缫��ӦʽΪ������2Cl����4e��=Cl2������������Ϊ224ml�����ʵ���Ϊ0.01mol��ԭ��Һ���Ȼ������ʵ���Ϊ0.02mol���Ȼ���Ũ��Ϊ�� ![]() =0.1mol/L��
=0.1mol/L��
���Դ��ǣ�4OH����4e��=O2��+2H2O��0.1����3����״����336mL���������ʵ���Ϊ�� ![]() =0.015mol��0.015mol������ȫ��Ӧ�õ����ӵ����ʵ���Ϊ��0.015mol��4=0.06mol���ɱ���t2ʱ��������Ϊ112mL�����������������ʵ���Ϊ��n��O2��=
=0.015mol��0.015mol������ȫ��Ӧ�õ����ӵ����ʵ���Ϊ��0.015mol��4=0.06mol���ɱ���t2ʱ��������Ϊ112mL�����������������ʵ���Ϊ��n��O2��= ![]() =0.005mol����ת�Ƶ���Ϊ��0.02mol+0.005mol��4=0.04mol�����ݵ����غ㼰Cu2++2e��=Cu��֪��n��CuSO4��=
=0.005mol����ת�Ƶ���Ϊ��0.02mol+0.005mol��4=0.04mol�����ݵ����غ㼰Cu2++2e��=Cu��֪��n��CuSO4��= ![]() =0.02mol��
=0.02mol��
���������������缫�Ͽ�����ͭ�����ʵ���Ϊ0.02mol������Ϊ��64g/mol��0.02mol=1.28g��
���Դ��ǣ�1.28����4����A�����������Һ�ӷ�̪����Һ���˵����Һ�Լ��ԣ�֤����Һ�в��������ˮ�⣬֤������Ϊ���ᣬ��A��ȷ��
B��ȡһ����������Һ��ˮϡ����10����pH�仯С��1˵����Һ�д��ڵ���ƽ�⣬֤������Ϊ���ᣬ��B��ȷ��
C��������ʹ����KMnO4��Һ��ɫ�Dz���Ļ�ԭ�ԣ�����˵������Ϊ���ᣬ��C����
D��ȡ��ͬpH�IJ�����Һ�����ᣬ�ֱ���������Ĵ�С����״��ͬ��þ����������Һ��Ӧ�ٶȿ�˵��������ڵ���ƽ�⣬֤������Ϊ���ᣬ��D��ȷ��
���Դ��ǣ�ABD���ڳ����£�0.1molL��1�IJ�����Һ��pH=13��NaOH��Һ�������ϣ�������Һ��pHΪ6����Һ��������Ũ��Ϊ0.05mol/L��������Ũ��10��6mol/L������������Ũ��= ![]() =10��8mol/L����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=c��HC2O4����+2c��C2O42����+c��OH������c��HC2O4����+2c��C2O42����=0.05+10��6��10��8 ��
=10��8mol/L����Һ�д��ڵ���غ㣬c��Na+��+c��H+��=c��HC2O4����+2c��C2O42����+c��OH������c��HC2O4����+2c��C2O42����=0.05+10��6��10��8 ��
���Դ��ǣ�0.05+10��6��10��8��
�����㾫�����������������ˮ��Һ�еĵ���ƽ���ǽ����ĸ�������Ҫ֪����������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.�ò����缫���MgCl2��Һ��2Cl��+2H2O ![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
B.��ͭ���缫�������ͭ��Һ��2Cu2++2H2O ![]() 4H++2Cu+O2��
4H++2Cu+O2��
C.����/KOHȼ�ϵ��������Ӧ��O2+4H++4e���T2H2O
D.������� 3Zn+2K2FeO4+8H2O ![]() 3Zn��OH��2+2Fe��OH��3+4KOH���ʱ��������Ӧ��Fe��OH��3��3e��+5 OH���TFeO42��+4H2O
3Zn��OH��2+2Fe��OH��3+4KOH���ʱ��������Ӧ��Fe��OH��3��3e��+5 OH���TFeO42��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽����������ϡ����������Һ�ķ�Ӧ��ʵ�������װ��A���ձ��ڵ���Һ�¶����ߣ�װ��B���ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣

��1��װ��A�ձ��з�Ӧ�����ӷ���ʽΪ_________��
��2��װ��B��Mg�ϵ�������_________��Al�����ĵ缫��Ӧʽ��__________________��
��3����װ��B������ͨ��0.3mol����ʱ��װ��B�ձ�����Һ�������仯Ϊ__________�������ػ������ٿˣ���
��4����С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________������ĸ��ţ���
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B��ԭ���װ����Ҫ2���缫
C���缫һ�����ܲμӷ�Ӧ
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
E��ԭ��ص�����������������Ļ���йأ�����Ҳ��������Һ�й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��CaC2O4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ� �� 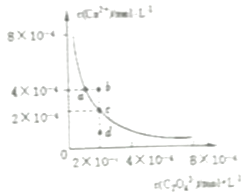
A.��CaC2O4������Һ�м������Na2C2O4������a��䵽b��
B.ͨ������������d��䵽c��
C.d����CaC2O4��������
D.a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹�м�����������������Ϊ1�s4ʱ��ը��ǿ�ң���ʱ�������������������
A. 1�s3 B. 1�s2 C. 1�s1 D. 2�s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3ClΪ��ɫ���Դ���ζ�����壬�ܶ�Ϊ2.25g/L���۵�Ϊ��24.2�棬��������ˮ���������Ҵ��ͱ������л��ܼ��� ��ʵ������ȡCH3Cl��ԭ����CH3OH+HCl��Ũ�� ![]() CH3Cl+H2O�����岽�����£�
CH3Cl+H2O�����岽�����£�
�ٸ���ZnCl2���壻
�ڳ�ȡ24g��ϸ����ˮZnCl2����ȡ20mLŨ�������Բ����ƿ��ͬʱ��ȡһ�����ļ״������Һ©���У�
�۽���Һ©����ļ״���ε�����ƿ�в����ȣ���ZnCl2��ȫ�ܽ����CH3Cl�����ݳ���������ˮ���ռ���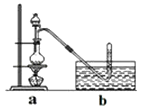
��ش�
��1��ʵ���Ҹ���ZnCl2�����Ƶ���ˮZnCl2�ķ�����
��2����Ӧ�����е�����ƿ�м״�������������٣��״���Ũ��������ʵ���Ũ�Ƚӽ����������� ��
��3��ʵ����Ϊ������ˮ���ռ�CH3Cl��
��4����ij���ϼ��أ�CH4�����е�һ��Hԭ�ӱ�Clԭ��ȡ�������ȶ����ܵ�Ӱ�죬�ɱ�ǿ���������Ը������������������ֻϴ��ƿ���ֱ�ʢ�������Լ��� A.1.5%KMnO4��H+����Һ�� B������ˮ��C.5%Na2SO3��Һ�� D.98%H2SO4
Ϊ֤ʵ��һ���۵Ŀɿ��ԣ��������ѡ����ǡ����ϴ��ƿ����aװ�����ɵ���������ͨ��ϴ��ƿ����ϴ��ƿ��ţ�������۲쵽��֤ʵ�������ϵ���ȷ�ԣ�
��5��д��ϴ��ƿ�з�����Ӧ�����ӷ���ʽ��CԪ�ص���������ΪCO2����
��6�����CH3Cl�Ǵ�������Ⱦ�����ϴ��ƿ֮��Ӧ��һֻʢ��ϴ��ƿ��
��7��ijС��ͬѧȡVmL��CH3Cl��Ⱦ��ˮ������ƿ�У���0.10molL��1����KMnO4��Һ���еζ���ʵ���������������ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.90 | 20.02 | 20.00 | 19.98 |
��һ��ʵ�����ݳ����쳣����������쳣��ԭ�������������ĸ���ţ���
a����ƿϴ����δ���� b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
c���ζ�����������ƿʱ��Һ�彦�� d���ζ��յ�ʱ���Ӷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӵ��������Ṥ���У�������Ӧ���ں��ݡ��¶�Ϊ450�沢�д������ڵ������½��У�2SO2��g��+O2��g��2SO3��g����H=��190kJ/mol ��������������˵��������Ӧ�Ѵ�ƽ����� ��
a��v��O2�����T2v��SO3���� b��������������ܶȲ���ʱ����仯
c�������������ƽ����Է�����������ʱ����仯 d������������ķ�����������ʱ����仯
����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20molSO2��0.10molO2 �� ����Ӻ�ﵽƽ�⣬��������к�SO30.18mol����v��O2��=molL��1min��1 �� ������ͨ��0.40mol SO2��0.20molO2��ƽ���ƶ����������Ӧ���������淴Ӧ�����������ٴδﵽƽ���mol��n��SO3����mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ�������ķ�����ȷ���ǣ� ��
A.���MgO��ȡMg
B.������������CO��ԭAg2O��ȡAg
C.��Al��F2O3��Ӧ�У�����11.2gFe��ת�Ƶ�����Ϊ0.6NA
D.���NaCl��Һ��ȡNa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����������Թ�������ֽ����ʵ�Ӱ�죬ij��ѧ��ȤС���ͬѧ��������ʵ�顣��ش��������⣺
��� | ʵ����� | ʵ������ |
�� | �ֱ����Թ�A��B�м���5mL5%H2O2��Һ��������2��1mol/LFeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��н��ݣ����Թ�B����ʢ��40��������ˮ���ձ��н��ݡ� | �Թ�A�в��ٲ������ݣ� �Թ�B�в��������������ࡣ |
�� | ��ȡ��֧�Թֱܷ����5mL5%H2O2��Һ��5mL10%H2O2��Һ�� | ��֧�Թ��о�δ���Լ��������ݲ����� |
��1��ʵ��ٵ�Ŀ��������������ͬʱ��̽��______������H2O2�ֽ����ʵ�Ӱ�졣
��2��ʵ���δ�۲쵽Ԥ�ڵ�ʵ������Ϊ�˰�������ͬѧ�ﵽʵ��Ŀ�ģ�������ʵ�������ṩ�ļ����Լ����������������еĸĽ���____________________________________��
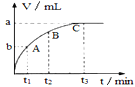
��3��ijͬѧ��50mLһ��Ũ�ȵ�H2O2��Һ�м��������Ķ������̣��ų�������������״���£��뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����A��B��C��������ʾ��˲ʱ��Ӧ������������____������ĸ���ţ���
��4������H2O2�ֽⷴӦ��Cu2+Ҳ��һ���Ĵ����á�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч�����û�ѧ��ȤС���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣��ش�������⣺
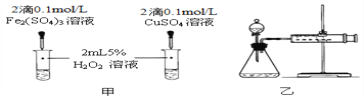
�ٶ��Է�������ͼ��ͨ���۲�________________________�����ԱȽϵó����ۣ���ʵ���н�FeCl3��Һ��ΪFe2(SO4)3��Һ��ԭ����______________________��
�ڶ�����������ͼ����ʾװ�����������飬ʵ��ʱ����3minʱ��Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԡ�ʵ������Ҫ������������________________����������Ϊ_______��
��5��ͨ��������ʵ����̵ķ�������ʵ�����ʱ��Ҫ����_________˼�뷽����Ӧ�á�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com