
【题目】为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究______条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________。
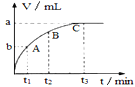
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____(填字母代号)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
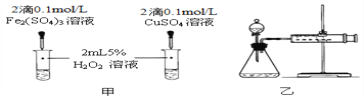
①定性分析:如图甲可通过观察________________________,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________,所需仪器为_______。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________思想方法的应用。
【答案】 温度 将两支试管同时放入盛有相同温度热水的烧杯中,观察产生气泡的速率或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率 C 溶液中产生气泡的速率 排除Cl对实验的干扰 在同温同压下,反应3min收集气体的体积 秒表或计时器 控制变量(或对比)
【解析】(1)根据控制变量法可知,实验①的目的是其它条件相同时,探究温度对H2O2分解速率的影响。
(2)实验②显然是要探究浓度对H2O2分解速率的影响,未观察到预期的实验现象,说明在该实验条件下,过氧化氢分解的速率太慢,为了达到实验目的,可以设法加快H2O2分解速率,因此,对上述操作进行的改进是:将两支试管同时放入盛有相同温度热水的烧杯中,观察产生气泡的速率或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率。
(3)由图中信息可知,在C点过氧化氢分解产生的氧气的体积达到最大,说明C点反应已完成,则A、B、C三点所表示的瞬时反应速率最慢的是C。
(4)①定性分析:如图甲可通过观察溶液中产生气泡的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除Cl对实验的干扰。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是:在同温同压下,反应3min收集气体的体积。所需仪器为计时仪器,可以是秒表或计时器。
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)思想方法的应用。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1: 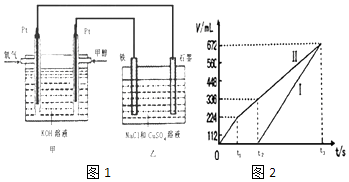
(1)写出甲中通入甲醇这一极的电极反应式 .
(2)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式,原混合溶液中NaCl的物质的量浓度为mol/L.(设溶液体积不变)
(3)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为g.
(4)已知草酸H2C2O4为弱酸. ①常温下,下列事实能说明草酸是弱电解质的是 .
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1molL﹣1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4)+2c(C2O42﹣)=(用准确的数学表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃ 时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ gcm﹣3 , 溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w= ![]() ×100%
×100%
B.溶质的物质的量浓度c= ![]() ?mol?L﹣1
?mol?L﹣1
C.溶液中c(OH﹣)= ![]() ?mol?L﹣1
?mol?L﹣1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
A.纯硫酸的摩尔质量为98
B.上述100mL稀硫酸中含溶质14g
C.上述稀释过程所需要的蒸馏水为90mL
D.质量分数为50%的硫酸物质的量浓度为7.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是( ) 
A.该有机物的分子式为C15H18O4
B.1mol该化合物最多可以与2molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中![]() 不变;
不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
A. ①⑤⑥ B. ①④⑤⑦ C. ①⑤⑥⑦ D. ①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中共有______种元素, ______种原子,中子数最多的是____________。
中共有______种元素, ______种原子,中子数最多的是____________。
(2)在 1—18 号元素中(稀有气体元素除外),能形成最稳定气态氢化物的元素是______;原子半径最大的元素是______。 最高价氧化物对应的水化物中, 碱性最强的是______,酸性最强的是______。(用相应的元素符号或化学式作答)
(3)在下列物质中: a.CaCl2 b.KOH c.Ne d.H2SO4 e.NH4Cl f.金刚石
其中不含化学键的物质是______;既含有离子键又含有共价键的物质是______;属于共价化合物的是_______。 (填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com