
| A、20mL0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1的NaOH溶液10mL,此时溶液中各微粒浓度的大小关系为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、由CH3(CH2)2CH3(g)+13/2O2(g)=4CO2(g)+5H2O(g)△H=-2658 kJ?mol-1,可知正丁烷的标准燃烧热为:-2658 kJ?mol-1 |
| C、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O 与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 |
| D、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |


科目:高中化学 来源: 题型:
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、金属性:甲>丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
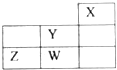 短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )| A、W的非金属性比Z的弱 |
| B、W的最高价氧化物对应的水化物是强酸 |
| C、Y的原子半径在同周期主族元素中最大 |
| D、Z的气态氢化物的稳定性在同主族元素中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,将盐酸滴加入醋酸钠溶液中至呈中性.此时溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| B、常温下,将0.1 mol?L-1氨水稀释10倍后,其pH大于12 |
| C、常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=4.9×10-5,则反应CaSO4(s)+CO32- (aq)═CaCO3(s)+SO42-(aq) 平衡常数K约为1.75×10-4 |
| D、溶有等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用加热分解氯化铵的方法制氨气 |
| B、向浓硫酸中缓慢加入乙醇和冰醋酸用以制备乙酸乙酯 |
| C、向2mL 10% NaOH溶液中,加入2mL 2mol/L CuSO4溶液,振荡制Cu(OH)2悬浊液,用于检验醛的性质 |
| D、加入Mg(OH)2固体可除去MgCl2溶液中混有的少量FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在酸碱中和滴定实验中可用传感技术绘制中和滴定曲线 |
| B、向试管中加入4mL 0.1mol?L-1K2Cr2O7溶液,再滴加数滴1 mol?L-1NaOH溶液,溶液颜色由黄色变为橙色 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加入2mL的水,以防过滤时烧杯中的硝酸钾晶体过早析出 |
| D、蒸馏时温度计水银球插在蒸馏烧瓶支管口的下方位置,将收集到高沸点馏分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
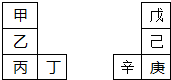
| A、乙的单质在空气中燃烧生成只含离子键的化合物 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、最高价氧化物的水化物的碱性:丙>乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
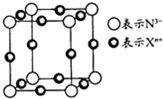 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com