
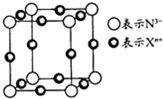
 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| n |
| 1 |
| 4 |
| 1 |
| 8 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、维生素在天然食品中含量丰富,所以加工后的食品中维生素含量也高 |
| B、人体细胞中的酸碱平衡是不能通过选择食物调节的 |
| C、为了食品安全,我国应该禁止使用食品防腐剂 |
| D、食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1的NaOH溶液10mL,此时溶液中各微粒浓度的大小关系为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、由CH3(CH2)2CH3(g)+13/2O2(g)=4CO2(g)+5H2O(g)△H=-2658 kJ?mol-1,可知正丁烷的标准燃烧热为:-2658 kJ?mol-1 |
| C、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O 与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 |
| D、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或反应 | 原理解释 | |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面生成的氧化物具有高熔点 |
| B | 钠和氧气在加热条件下进行反应 | 该反应为吸热反应 |
| C | 碳酸钠和氢氧化钠溶液中滴加酚酞,溶液都呈红色 | 碳酸钠和氢氧化钠都是碱 |
| D | 铁制容器可用于盛装冷的浓硫酸 | 铁与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、试剂X可能是葡萄糖 |
| B、试剂Z一定是CO2 |
| C、工业上可用CO还原固体2制取金属2 |
| D、工业上用固体3经一步反应制取金属3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和油脂能发生取代反应,不能发生氧化反应 |
| B、合成纤维、聚四氟乙烯都是高分子化合物 |
| C、乙酸、葡萄糖分子中都含羟基,都能与NaOH发生反应 |
| D、蛋白质溶液中滴入AgNO3溶液会析出沉淀,再加蒸馏水沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
| B、在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| C、在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com