

| ||
| ||


科目:高中化学 来源: 题型:
| A、一定温度下,将盐酸滴加入醋酸钠溶液中至呈中性.此时溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| B、常温下,将0.1 mol?L-1氨水稀释10倍后,其pH大于12 |
| C、常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=4.9×10-5,则反应CaSO4(s)+CO32- (aq)═CaCO3(s)+SO42-(aq) 平衡常数K约为1.75×10-4 |
| D、溶有等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
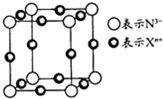 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )| A | B | C | D | |
| X | H2S | HCl | NH3 | NH3.H2O |
| Y | Na2SO3 | NaAlO2 | AlCl3 | AgNO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
| ||
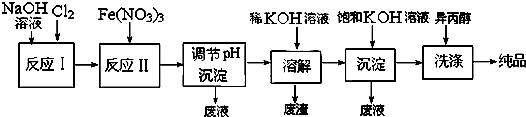
查看答案和解析>>
科目:高中化学 来源: 题型:
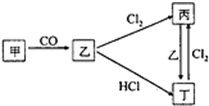 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com