
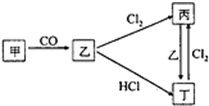
 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
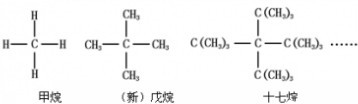
查看答案和解析>>
科目:高中化学 来源: 题型:

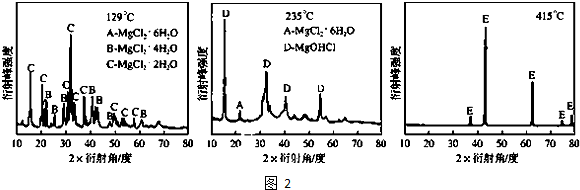

查看答案和解析>>
科目:高中化学 来源: 题型:
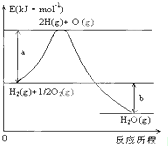 已知:H2(g)+
已知:H2(g)+| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
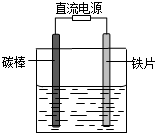 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )| A、碳棒接直流电源的负极 |
| B、碳棒上发生还原反应 |
| C、铁片附近出现的浑浊物是Mg(OH)2 |
| D、铁片上的电极反应式为2Cl--2e-=Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com