
| ||
| ||
| ||
| ||


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
| ||
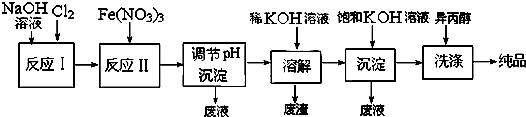
查看答案和解析>>
科目:高中化学 来源: 题型:
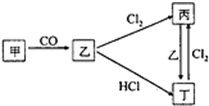 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
 已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:查看答案和解析>>
科目:高中化学 来源: 题型:
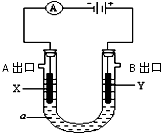 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
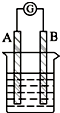 某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a+b=10 |
| B、a+b=12 |
| C、a+b=15 |
| D、a+b=16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6L氧气含有n个O2,则NA为4n |
| B、常温常压下,1mol氦气含有的原子数为2NA |
| C、常温下,1mol氧气和足量氢气反应,转移的电子数为2NA |
| D、18克水中所含的电子数为8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com