
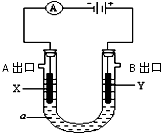
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
| ||
| ||||
| 0.4L |
| ||
| 2 |


科目:高中化学 来源: 题型:
 某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:
某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为
Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 3 |
| 2 |
2- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
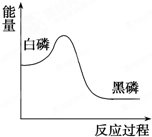 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( )| A、黑磷比白磷稳定 |
| B、黑磷与白磷互为同分异构体 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1稀硫酸100mL中含有硫酸根离子个数为0.1NA |
| B、常温常压下,氧气和臭氧的混合物16g中含有NA个氧原子 |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、NO2与足量的水完全反应,若有1molNO生成,则转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com