
 Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为
Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为| m |
| M |
| n |
| V |
| 1 |
| 50 |
| n |
| c |
| 1000ρω |
| M |
| n |
| V |
| 14.2g |
| 142g/mol |
| 0.1mol |
| 0.5L |
| 1 |
| 50 |
| 1 |
| 50 |
| 0.2mol/L×2×0.01L |
| 0.1L |
| 0.002mol |
| 0.1mol/L |
| 1000×1.04×36% |
| 60 |
| 0.25L×0.1mol/L |
| 6.24mol/L |
| n |
| V |
| n |
| V |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
 )为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得.写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
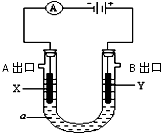 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是不可能发生的:Cl2+SO2+2H2O=2Cl-+SO42-+4H+ |
| B、氧化性:Cl2>Fe3+>I2 |
| C、还原性:I->Cl->Fe2+ |
| D、将SO2通入FeCl3溶液中得不到 SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com