


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
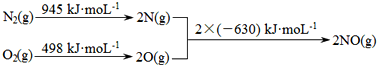
查看答案和解析>>
科目:高中化学 来源: 题型:
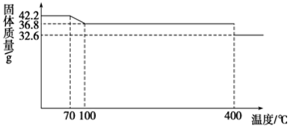 食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

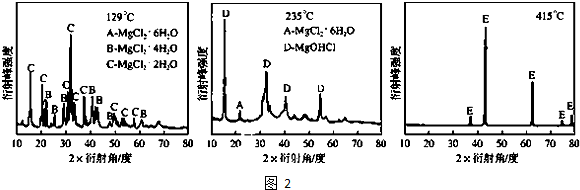

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为
Ⅰ.(1)用14.2g无水硫酸钠配制成500ml溶液,其物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 3 |
| 2 |
2- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属的冶炼方法与金属的活泼性有很大关系,所以银和汞可以用热分解的方法冶炼 |
| B、钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜 |
| C、工业上电解熔融氯化镁可制得金属镁,所以工业上电解熔融氯化铝可制得铝 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明镁比铝活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com