
| ||
| 3 |
| 2 |
2- 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
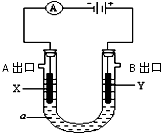 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
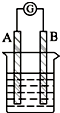 某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.7×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、pH相等的CH3COONa、NaClO和Na2CO3溶液:c(NaClO)<c(CH3COONa)<c(Na2CO3) |
| C、amol/L HClO溶液与bmol/L NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(ClO-),则b一定大于a |
| D、向0.1mol/L CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com