

| ||
| ||


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Դ�������ƹ���ʹ�������ڼ��ٹ⻯ѧ�����IJ��� |
| B�������γɵ���Ҫԭ��������β���������ŷ� |
| C���ƹ�ú��������Һ���������ṩ����Чȼ�� |
| D����K2FeO4ȡ��Cl2��������ˮ����ɱ���������ã��Ҳ����γ��°������ˮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
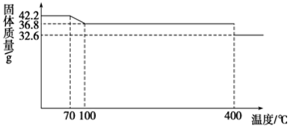 ʳ���еĿ�����������軯�أ��仯ѧʽΪK4[Fe��CN��6]?3H2O��42.2g K4[Fe��CN��6]?3H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȵı仯���ߣ���ͼ��ʾ��
ʳ���еĿ�����������軯�أ��仯ѧʽΪK4[Fe��CN��6]?3H2O��42.2g K4[Fe��CN��6]?3H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȵı仯���ߣ���ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
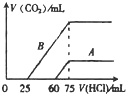
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

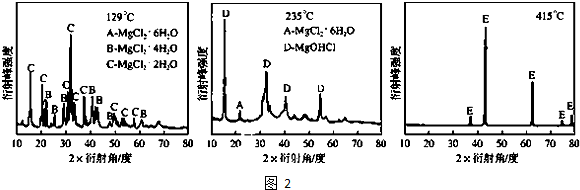

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
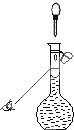 ��1����14.2g��ˮ���������Ƴ�500ml��Һ�������ʵ���Ũ��Ϊ
��1����14.2g��ˮ���������Ƴ�500ml��Һ�������ʵ���Ũ��Ϊ�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com