

| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
| 1 |
| 2 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水 | 溶液变成黄色.结论:可能是生成了Fe3+、也可能是生成了I2. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或 | 溶液不变红,说明I-的还原性强于Fe2+或 溶液变蓝,说明I-的还原性强于Fe2+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
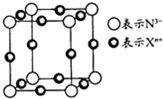 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
| ||
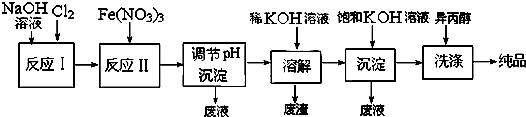
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称量NaOH的质量/g | 已给仪器 | 除已给仪器外还需要的其他仪器 |
| 烧杯、托盘天平、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
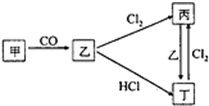 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
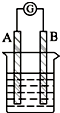 某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com