
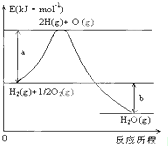
 已知:H2(g)+
已知:H2(g)+| 1 |
| 2 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
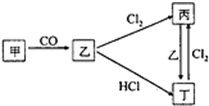 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量.根据以上所给的数据计算反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱:烧碱、碱石灰、纯碱 |
| B、分散系:溶液、胶体、浊液 |
| C、干燥剂:浓硫酸、生石灰、氯化钙 |
| D、物质分离方法:过滤、渗析、分馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com