
【题目】如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)

(1)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深,平衡向____________移动,NO2体积分数_______________
(2)压缩后U型管内左侧液面_______,右侧液面___________。
【答案】深浅最终正向减小上升下降
【解析】
(1)根据反应2NO2![]() N2O4△H<0,当左侧活塞迅速向里推时,相当于加压,气体的颜色先变深,后平衡正向移,气体颜色后变浅;但是由于体积缩小是主要因素,压缩体积气体浓度增大,颜色加深,因此最终和最初相比,最终气体颜色更深;NO2消耗的量增多,体积分数减小;综上所述,本题答案是:深,浅, 最终,正向, 减小。
N2O4△H<0,当左侧活塞迅速向里推时,相当于加压,气体的颜色先变深,后平衡正向移,气体颜色后变浅;但是由于体积缩小是主要因素,压缩体积气体浓度增大,颜色加深,因此最终和最初相比,最终气体颜色更深;NO2消耗的量增多,体积分数减小;综上所述,本题答案是:深,浅, 最终,正向, 减小。
(2)左侧注射器中,存在2NO2![]() N2O4△H<0可逆反应,右侧注射器中存有空气,因此现将两侧注射器活塞同时快速向内推到5mL,左侧增大压强,平衡向正反应方向进行,气体的物质的量减少,右侧空气不存在反应,因此左侧液面上升,右侧液面下降;综上所述,本题答案是:上升; 下降。
N2O4△H<0可逆反应,右侧注射器中存有空气,因此现将两侧注射器活塞同时快速向内推到5mL,左侧增大压强,平衡向正反应方向进行,气体的物质的量减少,右侧空气不存在反应,因此左侧液面上升,右侧液面下降;综上所述,本题答案是:上升; 下降。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
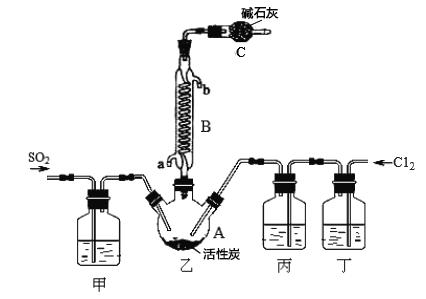
(1)从下表中选择相应的装置完成填空:
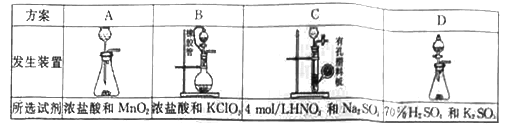
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA和2molB在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g)2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为30%④2s时物质B的浓度为0.7mol·L-1其中正确的是( )
A. ①③B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强酸弱碱形成的盐溶液呈碱性,则你认为“84消毒液”的有效成分是( )
A.氯化氢B.次氯酸钠C.高锰酸钾D.碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )
A.CO32-、Cl-B.NO3-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为工业从海水中提取液溴的流程图:
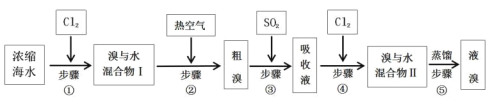
(1)当进行步骤①时,应关闭活塞_______,打开活塞____________。
已知:溴的沸点为 59 ℃,微溶于水,有毒性。某同学利用下图装置进行步骤①至步骤④的实验,请回答:
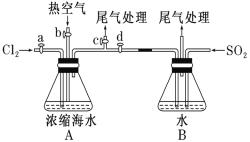
(2)步骤②中可根据_____________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是_____________。
(4)步骤⑤用下图装置进行蒸馏。装置 C 中直接加热不合理,应改为______,蒸馏时冷凝水应从______端进入(填“e”或“f”), F 的作用是________。
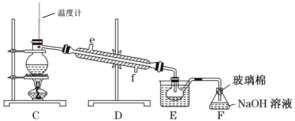
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
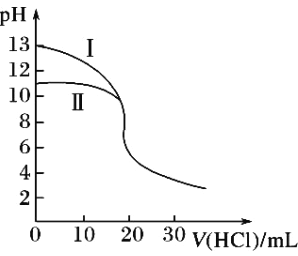
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d第一电离能大小关系为___________________,e的外围电子排布图为_____________________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_________;分子中既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写两种)。
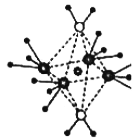
(3)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如下图所示)。该化合物中阴离子为__________,阳离子中存在的化学键类型有________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com