
【题目】用硫酸处理红土镍矿时要消耗大量的硫酸,同时产生大量的硫酸钠及硫酸镁。为再生硫酸,科研人员利用电解食盐水的原理制取硫酸,装置如图。
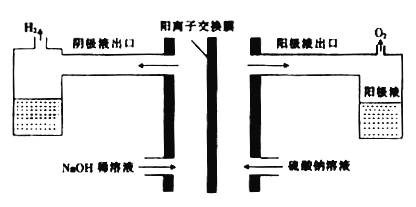
(1)电解时,阳极的电极反应式为____________________,电解过程中阴极周围溶液的PH______(“增大”“减小”或“不变”)。
(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是_____________________________。
(3)用电解原理也可处理含镍废水,同时还可回收金属镍,下图中①为__________(填“阴”或“阳”)离子交换膜。阴极上Ni2+放电时的电极反应式为______________________________。

【答案】 2H2O-4e-=4H++O2↑(或4OH- -4e-=2H2O+O2↑) 增大 将硫酸镁与阴极液反应制得氢氧化镁 阳 Ni2++2e-=Ni
【解析】(1)电解时,溶液中由水电离出来的氢氧根离子失电子产生氧气,则阳极的电极反应式为2H2O-4e-=4H++O2↑或4OH- -4e-=2H2O+O2↑,电解过程中阴极周围氢离子得电子产生氢气,氢氧根离子浓度增大,则溶液的PH增大;(2)硫酸镁销路不畅,而氢氧化镁较为畅销,获得氢氧化镁的方法是将硫酸镁与阴极液反应制得氢氧化镁;(3)该装置为电解池,图中右边池中废水中的氯离子进入中间区域,左边池中钠离子进行中间区域,故①应该为阳离子交换膜,阴极上Ni2+放电时生成镍单质析出在电极上,其电极反应式为:Ni2++2e-=Ni。


科目:高中化学 来源: 题型:
【题目】在2mL NaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液,沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是
A. Ag2S 、 AgI 、 AgCl B. AgCl 、 AgI 、 Ag2S
C. AgI 、 AgCl、 Ag2S D. AgCl 、 Ag2S 、 AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述正确的是( )
A. 单质的还原性:A>B>D>C B. a-c=1
C. 离子半径:C>D>B>A D. 原子半径:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解CuSO4溶液一段时间后,欲使溶液恰好恢复至电解前情
况,可加入的物质是 ( )
A. CuSO4 B. Cu(OH)2 C. Cu D. CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型燃料电池能以乙烯为原料制备乙醛并获得电能,工作原理如图所示。下列说法正确的是
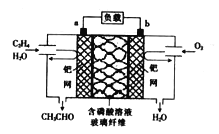
A. a电极为正极
B. 放电时,若有2mol电子转移,则理论上需要消耗28g乙烯
C. a极的电极反应式为CH2=CH2+2OH--2e-=CH3CHO+H2O
D. 电子移动方向:a电极→磷酸溶液→b电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂、400℃时可实现氯的循环利用,下图是其能量关系图下列分析正确的是
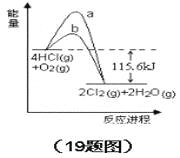
A. 曲线a是使用了催化剂的能量变化曲线
B. 反应物的总键能高于生成物的总键能
C. 反应的热化学方程式为:4HCl(g)+O2(g) = 2Cl2+2H2O(g)△H=-115.6 kJ
D. 若反应生成2mol液态水,放出的热量高于115.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 碳酸钙不溶于水,但溶于盐酸
B. 由2NO2(g)![]() N2O4(g)组成的平衡体系,加压后颜色加深
N2O4(g)组成的平衡体系,加压后颜色加深
C. 高压比常压有利于合成氨的反应
D. 用热的纯碱溶液洗油污时,去污效果好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com