
【题目】有5种短周期元素的原子序数按E、D、B、A、C 的顺序依次增大; A、C 同周期,B、C同主族;A 与B 可形成离子化合物A2B,A2B 中阴阳离子的电子层结构完全相同,且电子总数为30;D 和E可形成4 核10 电子的分子。试回答下列问题:
(1)写出这5种元素的名称: A______B______C______D______E______
(2)写出下列物质的电子式:
①D 元素形成的单质___________ ②B 与E 形成的四原子化合物________
③A.B、E 形成的化合物__________ ④D、E 形成的简单化合物__________
(3)B、D、E形成的原子个数3:2:4的盐的化学式为_______,类别属于______化合物(填离子或共价),含有的化学键类型__________。
【答案】 钠 氧 硫 氮 氢 ![]()
![]()
![]()
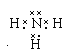 NH4NO3 离子 离子键和共价键
NH4NO3 离子 离子键和共价键
【解析】5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;D和E可形成4核10电子的分子,则分子为氨气,则E为H,D为N;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30,则A为Na,B为O;A、C同周期,B、C同主族,可知C为S,(1)5种元素的名称:A为钠,B为氧, C为硫,D为氮,E为氢;(2)①D元素形成的单质为氮气,其电子式为![]() ;②B与E形成的四原子化合物为过氧化氢,其电子式为
;②B与E形成的四原子化合物为过氧化氢,其电子式为![]() ;③A.B、E形成的化合物氢氧化钠,其电子式为
;③A.B、E形成的化合物氢氧化钠,其电子式为![]() ;④D、E形成的简单化合物氨气,其电子式为
;④D、E形成的简单化合物氨气,其电子式为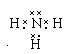 ;(3)B、D、E形成的原子个数3:2:4的盐的硝酸铵,其化学式为NH4NO3,类别属于离子化合物,含有的化学键类型离子键和共价键。
;(3)B、D、E形成的原子个数3:2:4的盐的硝酸铵,其化学式为NH4NO3,类别属于离子化合物,含有的化学键类型离子键和共价键。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
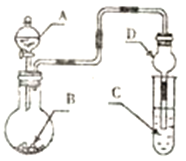
A. 若A为浓热酸,B为MnO2,C中盛有I2淀粉溶液,C中溶液变蓝色
B. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为浓H2SO4,B为CaCO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
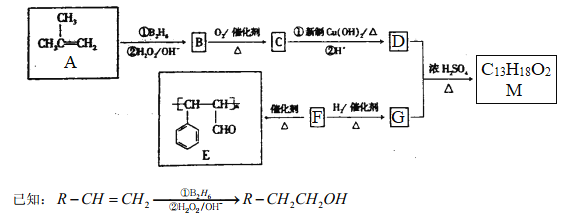
请回答下列问题:
(1)有机物A的系统命名为___________。
(2)F→E的反应类型为_________;B中所含官能团的名称为___________。
(3)M的结构简式为___________。
(4)C与新制Cu(OH)2悬浊液反应的化学方程式为___________。
(5)F有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有_____种。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线(无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢; 与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律:
(3)仪器B的名称为 ,干燥管D的作用为 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅和铅的化合物有广泛的用途,如Pb有感光性,也可用作金属着色剂,PbI2在潮湿空气中能被光逐渐分解,生成一氧化铅和碘。合成PbI2的实验流程如图所示。
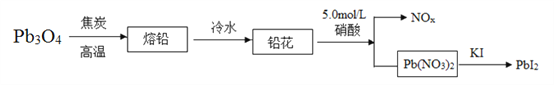
(1)若Fe3O4表示为氧化物形式是Fe2O3·FeO,将Pb3O4表示为氧化物形式是__________。
(2)将铅块制成铅花的目的是_______________。
(3)如果流程中生成的NOx为NO,则氧化剂与还原剂的物质的量之比为__________。
(4)PbI2在潮湿空气中能被光逐渐分解的化学方程式为_______________。
(5)硫酸铅可溶于醋酸铵饱和溶液中,请从化学反应原理角度解释:_____________________。
(6)铅主要的矿物有方铅矿(PbS)和铅钒矿(PbSO4),将二者以物质的量之比为1:1时加热得到金属铅和一种气体,有关反应的化学方程式是__________________。
(7)室温下,浓度均为4×10-3mo/L的KI和Pb(NO3)2溶液等体积混合,刚好能生成PbI2沉淀,则室温时PbI2的Ksp为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.5×10﹣16 , Ksp(Ag2CrO4)=2.0×10﹣12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com