
【题目】铅和铅的化合物有广泛的用途,如Pb有感光性,也可用作金属着色剂,PbI2在潮湿空气中能被光逐渐分解,生成一氧化铅和碘。合成PbI2的实验流程如图所示。
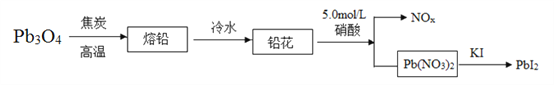
(1)若Fe3O4表示为氧化物形式是Fe2O3·FeO,将Pb3O4表示为氧化物形式是__________。
(2)将铅块制成铅花的目的是_______________。
(3)如果流程中生成的NOx为NO,则氧化剂与还原剂的物质的量之比为__________。
(4)PbI2在潮湿空气中能被光逐渐分解的化学方程式为_______________。
(5)硫酸铅可溶于醋酸铵饱和溶液中,请从化学反应原理角度解释:_____________________。
(6)铅主要的矿物有方铅矿(PbS)和铅钒矿(PbSO4),将二者以物质的量之比为1:1时加热得到金属铅和一种气体,有关反应的化学方程式是__________________。
(7)室温下,浓度均为4×10-3mo/L的KI和Pb(NO3)2溶液等体积混合,刚好能生成PbI2沉淀,则室温时PbI2的Ksp为___________。
【答案】 PbO2·2PbO 是为了增大与酸反应的接触面积,加快溶解反应速率 2:3 2PbI2+O2=2PbO+2I2 两者可反应生成难电离的可溶性盐(CH3COO)2Pb PbS+PbSO4![]() 2Pb+2SO2↑ 8.0×10-9
2Pb+2SO2↑ 8.0×10-9
【解析】(1)若Fe3O4表示为氧化物形式是Fe2O3·FeO,根据铅的主要化合价为+2和+4,可以将Pb3O4用氧化物形式表示为PbO2·2PbO。
(2)将铅块制成铅花的目的是为了增大与酸反应的接触面积,加快溶解反应速率。
(3)如果流程中生成的NOx为NO,则该反应的化学方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,其中氧化剂与还原剂的物质的量之比为2:3。
(4)由题意知,PbI2在潮湿空气中能被光逐渐分解,生成一氧化铅和碘,该反应的化学方程式为2PbI2+O2=2PbO+2I2。
(5)硫酸铅可溶于醋酸铵饱和溶液中,说明两者可发生复分解反应,生成难电离的可溶性盐(CH3COO)2Pb。
(6)铅主要的矿物有方铅矿(PbS)和铅钒矿(PbSO4),将二者以物质的量之比为1:1时加热得到金属铅和一种气体。根据质量守恒定律可知,该反应的化学方程式是PbS+PbSO4![]() 2Pb+2SO2↑。
2Pb+2SO2↑。
(7)室温下,浓度均为4×10-3mo/L的KI和Pb(NO3)2溶液等体积混合后,溶液中碘离子浓度和铅离子浓度均为2×10-3mo/L,因为刚好能生成PbI2沉淀,则室温时PbI2的Ksp为(2×10-3)3=8.0×10-9。


科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是____________(填元素名称),非金属性最强元素的是___________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
______________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是____________________;
元素D最高价氧化物的水化物的化学式为_________________。
(5)单质E与水反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种短周期元素的原子序数按E、D、B、A、C 的顺序依次增大; A、C 同周期,B、C同主族;A 与B 可形成离子化合物A2B,A2B 中阴阳离子的电子层结构完全相同,且电子总数为30;D 和E可形成4 核10 电子的分子。试回答下列问题:
(1)写出这5种元素的名称: A______B______C______D______E______
(2)写出下列物质的电子式:
①D 元素形成的单质___________ ②B 与E 形成的四原子化合物________
③A.B、E 形成的化合物__________ ④D、E 形成的简单化合物__________
(3)B、D、E形成的原子个数3:2:4的盐的化学式为_______,类别属于______化合物(填离子或共价),含有的化学键类型__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应的化学方程式为X(g)+Y(g) ![]() Z(g)
Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应开始到10 s,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镁可用于制造合金、储氢材料、镁电池等。
已知:C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol;
O2(g)=CO(g) △H=-110.5kJ/mol;
Mg(g)+ ![]() O2(g)=MgO(s)△H=-732.7kJ/mol。
O2(g)=MgO(s)△H=-732.7kJ/mol。
(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=____________。
(2)一种用水氯镁石(主要成分为MgC12·6H2O)制各金属镁工艺的关键流程如下:

①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为_____。“一段脱水”的目的是制备MgC12·2H2O,温度不高于180℃的原因是_______________。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为_________________。
③该工艺中,可以循环使用的物质有_______________。
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2(标准状况下)生成X,X的化学式为______________。
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com