
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
D. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某试样焰色反应呈黄色,则试样中一定含有K+
B.过滤操作时,为了加快过滤可以用玻璃棒搅拌漏斗的液体
C.蒸馏装置中,温度计水银球的位置应该在蒸馏烧瓶支管口附近
D.粗盐的提纯实验中,用到了萃取、分液操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如下图所示:
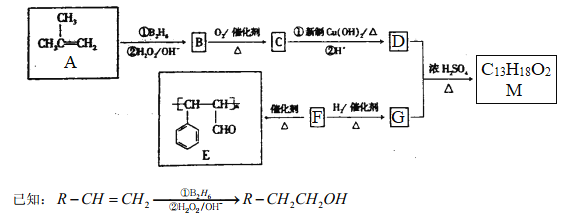
请回答下列问题:
(1)有机物A的系统命名为___________。
(2)F→E的反应类型为_________;B中所含官能团的名称为___________。
(3)M的结构简式为___________。
(4)C与新制Cu(OH)2悬浊液反应的化学方程式为___________。
(5)F有多种同分异构体,其中含苯环且与F所含官能团相同的同分异构体有_____种。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线(无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅和铅的化合物有广泛的用途,如Pb有感光性,也可用作金属着色剂,PbI2在潮湿空气中能被光逐渐分解,生成一氧化铅和碘。合成PbI2的实验流程如图所示。
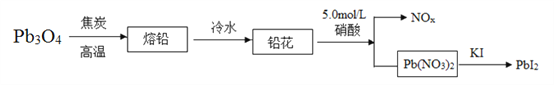
(1)若Fe3O4表示为氧化物形式是Fe2O3·FeO,将Pb3O4表示为氧化物形式是__________。
(2)将铅块制成铅花的目的是_______________。
(3)如果流程中生成的NOx为NO,则氧化剂与还原剂的物质的量之比为__________。
(4)PbI2在潮湿空气中能被光逐渐分解的化学方程式为_______________。
(5)硫酸铅可溶于醋酸铵饱和溶液中,请从化学反应原理角度解释:_____________________。
(6)铅主要的矿物有方铅矿(PbS)和铅钒矿(PbSO4),将二者以物质的量之比为1:1时加热得到金属铅和一种气体,有关反应的化学方程式是__________________。
(7)室温下,浓度均为4×10-3mo/L的KI和Pb(NO3)2溶液等体积混合,刚好能生成PbI2沉淀,则室温时PbI2的Ksp为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
A. 被氧化的物质是还原剂
B. 氧化剂被氧化,还原剂被还原
C. 失去电子,化合价降低的物质是还原剂
D. 氧化剂失去电子,化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.5×10﹣16 , Ksp(Ag2CrO4)=2.0×10﹣12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为pg .cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的有
①![]() ②
②![]() ③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯Zn片和纯Cu片用导线连接置于同一稀H2SO4 溶液中,下列各叙述中正确的是
A.Zn片上有大量气泡产生
B.负极附近c(SO42-),逐渐增大
C.正极、负极附近c(SO42-)基本不变
D.电子经电解质溶液由正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com