
【题目】金属镁可用于制造合金、储氢材料、镁电池等。
已知:C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol;
O2(g)=CO(g) △H=-110.5kJ/mol;
Mg(g)+ ![]() O2(g)=MgO(s)△H=-732.7kJ/mol。
O2(g)=MgO(s)△H=-732.7kJ/mol。
(1)一种制备镁的反应为MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=____________。
(2)一种用水氯镁石(主要成分为MgC12·6H2O)制各金属镁工艺的关键流程如下:

①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·H2O在不同温度下分解,测得残留固体物质的X-射线衔射谱图如下图所示(X-射线衔射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为_____。“一段脱水”的目的是制备MgC12·2H2O,温度不高于180℃的原因是_______________。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为_________________。
③该工艺中,可以循环使用的物质有_______________。
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2(标准状况下)生成X,X的化学式为______________。
(4)“镁—次氯酸盐”燃料电池的装置如图所示,该电池反应的总反应方程式为__________。

【答案】 +622.2kJ/mol MgO 若温度太高,MgCl2转化为MgOHC1或MgO 2MgOHC1+Mg=2MgO+MgCl2+H2↑ HC1、Cl2 Mg2NiH4 Mg+C1O-+H2O==Mg(OH)2+C1-
【解析】(1)①C(s)+ ![]() O2(g)=CO(g) △H=-110.5kJ/mol;②Mg(g)+
O2(g)=CO(g) △H=-110.5kJ/mol;②Mg(g)+ ![]() O2(g)=MgO(s)△H=-732.7kJ/mol。由①-②得,MgO(s)+C(s)=Mg(g)+CO(g),所以该反应的△H=(-110.5kJ/mol)-( -732.7kJ/mol)=+622.2kJ/mol。
O2(g)=MgO(s)△H=-732.7kJ/mol。由①-②得,MgO(s)+C(s)=Mg(g)+CO(g),所以该反应的△H=(-110.5kJ/mol)-( -732.7kJ/mol)=+622.2kJ/mol。
(2)①由题意可知,图中各峰线代表的都是某种纯净物。因为MgCl2·6H2O在加热过程中可以溶解在其结晶水中并发生水解,而且温度越高其水解程度越大,水解生成的氢氧化镁在受热时会发生分解生成氧化镁。因为MgO中Mg元素质量分数为60.0%,现测得E中Mg元素质量分数为60.0%,所以E可确定为MgO。“一段脱水”的目的是制备MgC12·2H2O,由图中信息及前面推断结果可知,在129℃“一段脱水”的主要产物是MgC12·2H2O,在235℃和415℃脱水的主要产物分别为MgOHC1和MgO,所以温度不高于180℃的原因是:若温度太高,MgCl2转化为MgOHC1或MgO。
②由题意知,MgOHCl与Mg反应,生成MgO钝化膜,镁的化合价升高了,只有H元素的化合价可以降低,故生成MgO的化学方程式为2MgOHC1+Mg=2MgO+MgCl2+H2↑。
③该工艺中,二段脱水需要HCl气流抑制氯化镁发生水解反应,脱水的产物中含有HCl;HCl是由氯气和氢气合成的,电解熔融的氯化镁可以得到Cl2,所以可以循环使用的物质有HC1、Cl2 。
(3)Mg2Ni是一种储氢材料。2.14gMg2Ni在一定条件下能吸收0.896LH2(标准状况下)生成X。2.14gMg2Ni的物质的量为0.02mol, 其中含n(Mg)=0.04mol、n(Ni)=0.02mol;在标准状况下,0.896LH2的物质的量为0.04mol,n(H)=0.08mol。n(Mg):n(Ni): n(H)=2:1:4,所以X的化学式为Mg2NiH4 。
(4)由“镁—次氯酸盐”燃料电池的装置图中信息可知,该电池工作时,镁被氧化为Mg(OH)2,C1O-被还原为C1-,所以该电池反应的总反应方程式为Mg+C1O-+H2O==Mg(OH)2+C1-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铅和铅的化合物有广泛的用途,如Pb有感光性,也可用作金属着色剂,PbI2在潮湿空气中能被光逐渐分解,生成一氧化铅和碘。合成PbI2的实验流程如图所示。
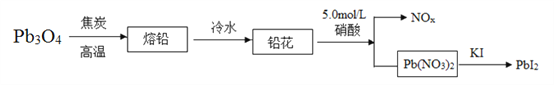
(1)若Fe3O4表示为氧化物形式是Fe2O3·FeO,将Pb3O4表示为氧化物形式是__________。
(2)将铅块制成铅花的目的是_______________。
(3)如果流程中生成的NOx为NO,则氧化剂与还原剂的物质的量之比为__________。
(4)PbI2在潮湿空气中能被光逐渐分解的化学方程式为_______________。
(5)硫酸铅可溶于醋酸铵饱和溶液中,请从化学反应原理角度解释:_____________________。
(6)铅主要的矿物有方铅矿(PbS)和铅钒矿(PbSO4),将二者以物质的量之比为1:1时加热得到金属铅和一种气体,有关反应的化学方程式是__________________。
(7)室温下,浓度均为4×10-3mo/L的KI和Pb(NO3)2溶液等体积混合,刚好能生成PbI2沉淀,则室温时PbI2的Ksp为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯Zn片和纯Cu片用导线连接置于同一稀H2SO4 溶液中,下列各叙述中正确的是
A.Zn片上有大量气泡产生
B.负极附近c(SO42-),逐渐增大
C.正极、负极附近c(SO42-)基本不变
D.电子经电解质溶液由正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中Z单质的沸点最高
B.X和W的常见单质的分子式分别为X2和W2
C.W的氢化物沸点比X的氢化物的沸点低
D.R最高氧化物水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.试推断: 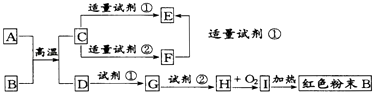
(1)写出物质的化学式:A:B:C:Ⅰ: .
(2)向F中逐滴滴加试剂①的现象为 .
(3)写出下列反应的方程式: C→E的离子方程式
C→F的离子方程式
G→H的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙的某些性质如表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.过滤B.蒸发C.蒸馏D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com