
【题目】1.52g铜镁合金完全溶解于足量的浓硝酸中,得到NO2气体1344mL (标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,发现金属离子全部沉淀,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.可得到2.54 g沉淀
C.如果是铜铝合金,则产生的NO2 的体积不会是1344mL
D.恰好全部沉淀时,加入NaOH溶液的体积是600 mL
【答案】D
【解析】解:A、假设在1.52 g铜镁合金中含有的Mg、Cu的物质的量分别是x、y,则根据质量守恒,可以建立24x+64y=1.52,根据化学方程式可建立(2x+2y)×22400=1344,解得x=0.01mol,y=0.02mol,所以该合金中铜与镁的物质的量之比是2:1,故A正确;B、沉淀的质量等于合金的质量和氢氧根离子的质量,金属失去1mol的电子生成沉淀时就结合1mol的氢氧根离子,所以沉淀质量为:1.52g+ ![]() =2.54g,故B正确;
=2.54g,故B正确;
C、铜铝合金中的铝遇到浓硝酸在常温下出现钝化现象,所以产生的NO2只能靠铜来完成反应,所以实际产生的NO2气体体积应该小于1344mL,故C正确;
D、根据原子守恒可以推导出关系式:Cu~Cu(OH)2~2NaOH,Mg~Mg(OH)2~2NaOH,于是计算出进行这两个反应消耗的NaOH的物质的量=0.01×2+0.02×2=0.06mol,但是考虑到硝酸是足量,应该还发生反应HNO3+NaOH=NaNO3+H2O,可见实际上完全沉淀时消耗的NaOH的物质的量要大于0.06mol,相应的加入NaOH溶液的体积也应该大于600mL,故D错误;
故选:D.


科目:高中化学 来源: 题型:
【题目】从某NaOH溶液中取任意体积的溶液时,下列物理量一定没有发生变化的是( )
A. 溶液中NaOH的物质的量 B. 溶液中Na+的物质的量浓度
C. 溶液中Na+的数目 D. 溶液的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的胃壁能产生胃液,胃液里含有少量盐酸,称为胃酸。胃过多会导致消化不良和胃痛。抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部的不适。下列物质不能作抗酸药的是( )
A.碳酸氢钠B.氢氧化铝C.碳酸镁D.硫酸钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列诗句或谚语, 说法不正确的是( )
A. “千淘万漉虽辛苦,吹尽狂沙始到金” (唐·刘禹锡 )描述的过程主要是物理变化
B. “水乳交融,火上浇油” 前者包含物理变化,而后者包含化学变化
C. “滴水石穿、绳锯木断” 不包含化学变化
D. “落汤螃蟹着红袍” 肯定发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH﹣)=1×10﹣9molL﹣1
B.饱和氯水中:c(Cl﹣)=c(ClO﹣)+c(HClO)
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应离子方程式为:2Fe3++Fe═3Fe2+ , 能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害.下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收.
(1)(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
加入新制氯水后溶液中发生的离子反应方程式是、Fe3++SCN﹣[Fe(SCN)]2+ .
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+ . 该离子存在的原因可能是(填编号) .
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由 .
(4)(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++8H++MnO4﹣=5Fe3++Mn2++4H2O.准确称量上述药品10.00g,将其全部溶于试剂2中,配 制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL. 该实验中的试剂2与甲同学设计的实验中的试剂1都可以是(填序号).
A.蒸馏水
B.稀盐酸
C.稀硫酸
D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的(填编号).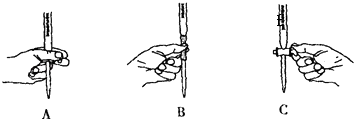
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25.使混合气通过足量溴水,溴水增重8.4g.则混合气中的烷烃的结构简式是 , 物质的量是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com