
����Ŀ��������Ѫ�쵰����Ҫ��ɳɷ֣�������������֯����O2�����ã����ȱ���Ϳ��ܳ���ȱ����ƶѪ�����������������Ҳ�к���������һ�ֳ�����ҩƷ˵�����еIJ������ݣ���ҩƷ��Fe2+33%��36%��������ˮ�������������е�θ���Vc��ά����C��ͬ�������ӱ�Ʒ���գ�
��1����һ����ͬѧ�����������ʵ����ò���ҩƷ���Ƿ���Fe2+��̽��Vc�����ã�
����������ˮ����Һ�з��������ӷ�Ӧ����ʽ����Fe3++SCN��[Fe��SCN��]2+ ��
��2������KSCN��Һ����Һ��Ϊ����ɫ��˵����Һ��������Fe3+ �� �����Ӵ��ڵ�ԭ������ǣ����ţ� ��
A.ҩƷ�е���������Ӧ��������������ʽ����
B.����ҩ��������������������
C.ҩƷ�������������������������
��3��ҩƷ˵�����С���Vcͬ�������ӱ�Ʒ���ա���˵������ ��
��4����������ͬѧ�����������������ø�����ر���Һ�ζ��ķ����ⶨ��ҩƷ�Ƿ�ϸ�Ӧԭ��Ϊ5Fe2++8H++MnO4��=5Fe3++Mn2++4H2O��ȷ��������ҩƷ10.00g������ȫ�������Լ�2�У��� �Ƴ�1000mL��Һ��ȡ��20.00mL����0.0200mol/L��KMnO4��Һ�ζ�����ȥKMnO4��Һ12.00mL�� ��ʵ���е��Լ�2���ͬѧ��Ƶ�ʵ���е��Լ�1��������������ţ���
A.����ˮ
B.ϡ����
C.ϡ����
D.ϡ����
��5����ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ�������ţ���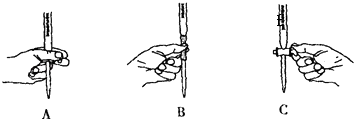
��6����ͨ�����㣬˵����ҩƷ�����������Ƿ�ϸ�д����Ҫ������̣���
���𰸡�
��1��2Fe2++Cl2=2Cl��+2Fe3+
��2��BC
��3��Fe2+������Ѫ�쵰��������O2�����ã�Fe3+û�д˹��ܣ�����Vc���ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2�����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+��
��4��C
��5��A
��6���⣺�躬��������Ϊxmol����
5Fe2++8H++MnO4���T5Fe3++Mn2++4H2O
5 1
x 0.02mol��12��0.001L��
x=1.2��10��3mol��
1000mL��Һ��ȡ��20.00mL����ҩƷ�к�n��Fe2+��=0.0200mol/L��12.00��10��3L��5�� ![]() =0.0600mol��
=0.0600mol��
m��Fe2+��=0.0600mol��56g/mol=3.36g��
����������Ϊ�� ![]() ��100%=33.6%�����ĺ�����33%��36%��Χ�ڣ��ʺϸ�
��100%=33.6%�����ĺ�����33%��36%��Χ�ڣ��ʺϸ�
�𣺸�ҩƷ�ϸ�
���������⣺��1������������ˮ���������ӱ�����Ϊ�����ӣ����ӷ�ӦΪ2Fe2++Cl2=2Cl��+2Fe3+ �� ���Դ��ǣ�2Fe2++Cl2=2Cl��+2Fe3+����2�����������ױ�������������ҩ������������������������ҩƷ������������������������ɣ�
���Դ��ǣ�B��C����3��VcƬ���л�ԭ�ԣ��ܹ���ԭ�������������ɶ��������ӣ�Fe2+������Ѫ�쵰��������O2�����ã�Fe3+û�д˹��ܣ�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+����
���Դ��ǣ�Fe2+������Ѫ�쵰��������O2 �����ã�Fe3+û�д˹��ܣ�����Vc���ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+������4���Լ�1���ܽ����ã����ᡢϡ������ɣ����Լ�2���������ᣬ�ױ��������������Ӱ��ʵ��ⶨ�����ʵ���е��Լ�2���ͬѧ��Ƶ�ʵ���е��Լ�1��������ϡ���ᣬ
���Դ��ǣ�C����5��KMnO4��Һ����ʽ�ζ���ʢ�ţ��ζ�ʱ������ת������ֻ��ͼA���ϣ�
���Դ��ǣ�A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�����£�PH=9��̼������Һ����ˮ�������c��OH����=1��10��9molL��1
B.������ˮ�У�c��Cl����=c��ClO����+c��HClO��
C.��pH=4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
D.�к͵����pH��ͬ��H2SO4��HCl��Һ������NaOH�����ʵ���Ϊ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���������Ũ�����У��õ�NO2����1344mL ����״��������Ӧ�����Һ�м���1.0mol/L NaOH��Һ�����ֽ�������ȫ������������˵������ȷ���ǣ� ��
A.�úϽ���ͭ��þ�����ʵ���֮����2��1
B.�ɵõ�2.54 g����
C.�����ͭ���Ͻ��������NO2 �����������1344mL
D.ǡ��ȫ������ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ܱպ��������м���1.0mol/L X��������Ӧ��2X��g��Y��g��+Z��g������H��0����Ӧ��8minʱ�ﵽƽ�⣻��14minʱ�ı���¶ȣ�16minʱ������ƽ�⣮X�����ʵ���Ũ�ȱ仯��ͼ��ʾ�������й�˵����ȷ���ǣ� �� 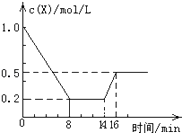
A.0��8min��Y��ʾ�ĸ÷�Ӧ���ٶ�Ϊ0.1mol/Lmin
B.8minʱ�ﵽƽ�⣬�÷�Ӧ��ƽ�ⳣ��Ϊ K=0.5
C.14minʱ���ı�ķ�Ӧ�����ǽ�������ϵ���¶�
D.16minʱ������Ӧ���ʣ���8minʱ������Ӧ���ʴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������д���¿հף�
��1�����������ʣ� ��NaHSO4���� ��SO3 ��Һ̬���� ���� ��BaSO4���� ������ FeCl3��Һ ��
�ƾ���C2H5OH�� �����ڵ� K2SO4�������ܵ������__________�����ڵ���ʵ���_________�����ڷǵ���ʵ���______________
��2�� ��ѧ��Ӧ FeS+ H2SO4��Ũ��![]() Fe2(SO4)3+ SO2��+ S��+ H2O��δ��ƽ���У�
Fe2(SO4)3+ SO2��+ S��+ H2O��δ��ƽ���У�
���������ǣ�_______�� ��ԭ�����ǣ�_______��
��3�� ��д������������������Һ��Ӧ�����ӷ���ʽ_______��
��4�� ������Գ����⣬ ��д��������Ӧ�����ӷ���ʽ_______��
��5�� ��ҵ�ϳ��� H2O2������������������ˮ�е� Fe2+����д�����ӷ���ʽ��_______��
��6��ijҺ̬������ X2Y4���������ȼ�ϡ� 32 g X2Y4��һ������ O2��ǡ����ȫȼ�գ���Ӧ����ʽΪ�� X2Y4(l)��O2(g) ![]() X2(g)��2Y2O(l)����ȴ���ڱ�״���²������������Ϊ 22.4 L�����ܶ�Ϊ 1.25 g��L��1�� X2��Ħ������Ϊ_____________�� X2Y4��ѧʽΪ________________����ע�� l��Һ̬�� g����̬��
X2(g)��2Y2O(l)����ȴ���ڱ�״���²������������Ϊ 22.4 L�����ܶ�Ϊ 1.25 g��L��1�� X2��Ħ������Ϊ_____________�� X2Y4��ѧʽΪ________________����ע�� l��Һ̬�� g����̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/L H2A��Һ�еμ�0.2mol/L NaOH��Һ���й��������ʵ����仯��ͼ�����Т����H2A�������HA�� �� �����A2������ʾ������ͼʾ�жϣ�����˵����ȷ���ǣ� �� 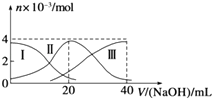
A.��V��NaOH��=20mLʱ����Һ������Ũ�ȴ�С��ϵ��c��Na+����c��HA������c��A2������c��H+����c��OH����
B.��Ũ�ȵ�NaOH��Һ��H2A��Һ��2��1��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮС
C.NaHA��Һ�У�c��OH����+c��A2����=c��H+��+c��H2A��
D.����������20mL NaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH���ܼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�Ӻ�������Ų���������������ȷ����
A.����������Ǿ������Ų���������͵ĵ��Ӳ�
B.ÿһ�����Ӳ��������ɵĵ�����Ϊ2n2
C.ijԭ�ӵĺ����������������8������
D.��M��Ϊ�����ʱ����������18������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. �ᡢ��ζ��ǵ���� B. ����ʶ���������ˮ������
C. �����ﶼ�ǵ���� D. �⻯�ﶼ���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ھƾ��ƻ����ϼ��ȵ������� (����)
A. �Թ� B. ����ƿ C. �ձ� D. ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com