
【题目】锂离子电池历经半个世纪岁月的考验,作出重大贡献的三位科学家被授予2019 年诺贝尔化学奖。磷酸亚铁锂( LiFePO4)是新型锂离子电池的正极材料。某小组拟设计以一种锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)为原料制备纯净的碳酸锂,进而制备LiFePO4的工艺流程:
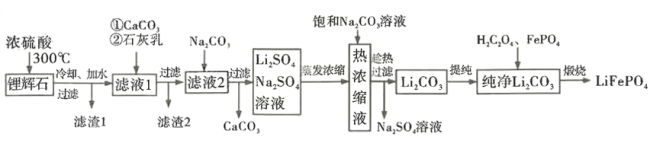
已知:LiO2·Al2O3·4SiO2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
回答下列问题:
(1) LiFePO4含有锂、铁两种金属元素,它们焰色反应的颜色分别是_____________(填序号)。
A.紫红色、无焰色反应 B.黄色、无焰色反应
C.黄色、紫色 D.洋红色、黄绿色
(2)滤渣1的主要成分是_____________;向滤液1中加入适量的CaCO3细粉用于消耗硫酸并将Fe3+转化为红褐色沉淀,若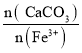 =3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
=3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是________。
(4)煅烧制备LiFePO4时,反应的化学方程式为_____________________。
(5)某种以LiFePO4,作正极材料的锂电池总反应可表示为: LiFePO4+C![]() Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
【答案】A Al2O3·4SiO2·H2O Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑或Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑ Mg(OH)2 FeO(OH)或FeOOH 减小LiCO3的溶解损失 Li2CO3+H2C2O4+2FePO4![]() 2LiFePO4+3CO2↑+H2O↑ Li1-xFePO4+xLi++xe- =LiFePO4
2LiFePO4+3CO2↑+H2O↑ Li1-xFePO4+xLi++xe- =LiFePO4
【解析】
锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)加入浓硫酸共热,根据已知信息可知得到的沉淀1主要成分为Al2O3·4SiO2·H2O,滤液中的主要阳离子有Fe3+、Mg2+、Ca2+、Li+;加入碳酸钙和石灰乳可以将过量的氢离子和Fe3+、Mg2+除去,滤渣2主要为Fe(OH)3、Mg(OH)2以及硫酸钙;滤液主要杂质离子有Ca2+和SO42-;再加入碳酸钠将钙离子除去,得到硫酸锂和硫酸钠的混合溶液,蒸发浓缩后加入饱和碳酸钠溶液,趁热过滤得到碳酸锂沉淀;提纯后加入草酸和磷酸铁经煅烧得到LiFePO4。
(1)锂元素的焰色反应为紫色;铁元素无焰色反应,所以选A;
(2)根据分析可知,滤渣1主要为Al2O3·4SiO2·H2O;得到的红褐色沉淀应为Fe(OH)3,再结合![]() =3以及溶液中有过量的硫酸,所以离子方程式为Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑,考虑到溶液中有大量硫酸根也可以写成Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;摩尔质量为89 g·mol -1,则该物质的式量为89,Fe(OH)3的式量为107,107-89=18,说明脱水过程失去一分子水,所以新物质的化学式为:FeO(OH);
=3以及溶液中有过量的硫酸,所以离子方程式为Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑,考虑到溶液中有大量硫酸根也可以写成Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;摩尔质量为89 g·mol -1,则该物质的式量为89,Fe(OH)3的式量为107,107-89=18,说明脱水过程失去一分子水,所以新物质的化学式为:FeO(OH);
(3)碳酸锂在水中的溶解度随温度升高而减小,所以趁热过滤可以减小碳酸锂的溶解度,减少碳酸锂的损耗;
(4)煅烧制备过程的原料为Li2CO3、H2C2O4和FePO4,产物中有LiFePO4,铁元素的化合价降低,则该过程中某种物质被氧化,根据元素化合价变化规律可知草酸中的C元素被氧化,由+3价升高为+4价,结合电子守恒和元素守恒可知方程式为:Li2CO3+H2C2O4+2FePO4![]() 2LiFePO4+3CO2↑+H2O↑;
2LiFePO4+3CO2↑+H2O↑;
(5)放电时正极得电子发生还原反应,负极失电子被氧化,根据总反应可知负极应为CLix-xe-=xLi++C,正极反应等于总反应减去负极反应,所以正极反应为:即Li1-xFePO4+xLi++xe- =LiFePO4。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。
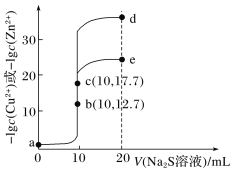
A.a~b~d为滴定ZnCl2溶液的曲线
B.对应溶液pH:a<b<e
C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)]
D.d点纵坐标约为33.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式___________。写出C原子的电子排布式___________
(2)四种元素中非金属性最强的元素是____,金属性最强的元素是_____,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物胃复安:

已知: ![]()
请回答:
(1)化合物A的结构简式_______。
(2)下列说法不正确的是_______。
A.化合物B能发生加成反应 B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性 D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D 的合成路线(用流程图表示,试剂任选) _______。
(4)写出D+EF的化学方程式_______。
(5)写出化合物E可能的同分异构体的结构简式_______,须同时符合:①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N一H键存在;②分子中没有同一个碳上连两个( )氮的结构。
)氮的结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为_____。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC![]() 的立体构型为________(用文字描述)。
的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________,电子式为__________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
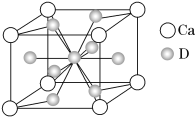
(5)镍元素的原子价电子排布式为_____________________.
镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________________(填数值);氢在合金中的密度为_____________。(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——有机化学基础)
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:![]()
(1)能与银氨溶液反应的B的同分异构体的结构简式为_________________,
(2)D的结构简式为____________,①的反应类型为_____________,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及___________,
(4)由F和G生成H的反应方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com