
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

【答案】M 9 bcd 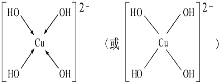 [Cu(H2O)4]SO4H2O 3 sp3杂化
[Cu(H2O)4]SO4H2O 3 sp3杂化
【解析】
(1)基态Si原子的电子排布式是1s22s22p23s23p2,第三层有3s、3p、3d 三个能级;
(2)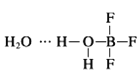 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,根据胆矾结构示意图可知Cu2﹣与H2O通过配位键结合成[Cu(H2O)4]2+。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4。
(1)基态Si原子的电子排布式是1s22s22p23s23p2,电子占据的最高能层为第三层,符号为M,第三层有1个3s轨道、3个3p轨道、5个3d轨道,具有的原子轨道数为9;
(2)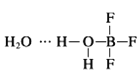 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,结构示意图为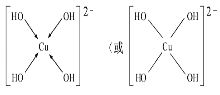 ,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子,第一电离能介于B、N之间的第二周期元素有Be、C、O,共3种;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,S原子杂化方式是sp3杂化。


科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素并且原子序数依次增大,其中只有A、B、C在同一周期。A元素原子核外成对电子数是未成对电子数的2倍;B元素最外层有3个未成对电子;C元素核外有3对成对电子;D元素是所在周期中原子半径最小的;E元素位于周期表的第四周期第九列。请根据相关信息,应化学用语回答下列问题:
(1)A的基态原子核中核外有___种运动状态不同的电子;B的基态原子中电子占据最高能级的电子云轮廓图为____。D的基态原子核外有____种能量不同的电子。
(2)B的氢化物BH3的VSEPR模型为____,其分子空间构型为_____;A、B、C三种元素的第一电离能由大到小的顺序为_____(填元素符号)。
(3)BO2-中B原子的杂化轨道类型为____;与AB-互为等电子体的分子有_____,离子有_____。(分别写出1种)
(4)由A、C与氢形成H2A2C4分子中,1mol该分子中含有π键的数目为____。
(5)E元素位于元素周期表中的___区,E3+的一种配离子[E(BH3)5D]2+中,E3+的配位数为____,配位原子为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列转化关系,请回答下列问题(部分反应条件未注明)。
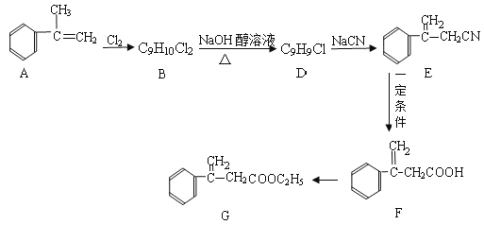
(1)F的官能团名称________________;
(2)B→D的化学反应方程式为____________;
(3)D→E的化学反应类型为_____________________;
(4)F转化为G的化学反应方程式为_________________;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
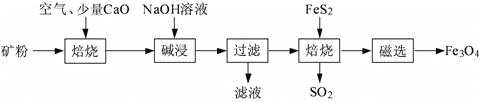
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为:___________________。
(2)“过滤”得到的滤渣中含有大量的Fe2O3。
①不添加CaO的矿粉焙烧时,其中FeS2转化为Fe2O3时发生的化学方程式:____________。
②添加质量分数为1%CaO后,硫元素最终转化为______________。(填化学式)
(3)向“过滤”得到的滤液中通入过量CO2,含铝元素的物质发生转化的离子方程式为_____________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(Fe2O3)∶n(FeS2)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列各组物质:(以下各题请按要求填写相应编号)
A.O2和O3 B.![]() C和
C和![]() C C.
C C.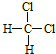 和
和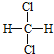 D.CH3CH2CH2CH3和
D.CH3CH2CH2CH3和 E.甲烷和庚烷 F.CH(CH3)3和C(CH3)4 G.C3H8和C10H22 H.CH2=CH2和CH3CH=CH2 I.H2和D2 J.C3H6和C5H10
E.甲烷和庚烷 F.CH(CH3)3和C(CH3)4 G.C3H8和C10H22 H.CH2=CH2和CH3CH=CH2 I.H2和D2 J.C3H6和C5H10
(1)___组互为同位素;
(2)___组两物质互为同素异形体;
(3)___组两物质互为同系物;
(4)___组两组物质互为同分异构体;
(5)___组中的物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物 说法正确的是
说法正确的是
A. 1mol该物质所含原子数为![]()
B. 该物质系统命名为2,3-二甲基-5-乙基己烷
C. 该物质一个分子中最多10个碳原子共平面
D. 该物质为某炔烃加氢后的产物,则可能的炔烃的结构只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com