
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
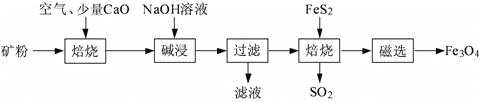
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为:___________________。
(2)“过滤”得到的滤渣中含有大量的Fe2O3。
①不添加CaO的矿粉焙烧时,其中FeS2转化为Fe2O3时发生的化学方程式:____________。
②添加质量分数为1%CaO后,硫元素最终转化为______________。(填化学式)
(3)向“过滤”得到的滤液中通入过量CO2,含铝元素的物质发生转化的离子方程式为_____________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(Fe2O3)∶n(FeS2)=_______。
【答案】SO2+OH =HSO3 4FeS2+11O2![]() 2Fe2O3+8SO2 CaSO4 AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- 16:1
2Fe2O3+8SO2 CaSO4 AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- 16:1
【解析】
由流程可知,矿粉焙烧时,矿粉中的FeS2与O2反应生成Fe2O3和SO2,在空气中CaO可将SO2转化为CaSO4;“碱浸”时,Al2O3、SiO2转化为溶于水的NaAlO2、Na2SiO3;Fe2O3和FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2。
(1)SO2属于酸性氧化物,用NaOH溶液吸收过量SO2生成HSO3,则发生反应的离子方程式为:SO2+OH =HSO3;
答案为:SO2+OH =HSO3;
(2).①不添加CaO的矿粉焙烧时,其中FeS2转化为Fe2O3和SO2,发生的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
答案为:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
②添加质量分数为1%CaO后,SO2与CaO反应生成CaSO3,CaSO3在空气中高温煅烧下又可转化为分解温度较高的CaSO4;
答案为:CaSO4;
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,“过滤”得到的滤液中主要含有AlO2,向“过滤”得到的滤液中通入过量CO2,可以将AlO2转化为Al(OH)3。反应为:AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3- ;
答案为:AlO2-+CO2+ 2 H2O = Al(OH)3 ↓+ HCO3-;
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,设有xmolFe2O3和ymolFeS2完全参加反应,将四氧化三铁中铁元素的化合价看成+![]() ,根据电子得失守恒:2x×(3
,根据电子得失守恒:2x×(3![]() )=2y×5+y×(
)=2y×5+y×(![]() 2),解得
2),解得![]() =16,所以理论上完全反应消耗的n(Fe2O3):n(FeS2)=16:1。
=16,所以理论上完全反应消耗的n(Fe2O3):n(FeS2)=16:1。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池 (DMFC) 具备低温快速启动、燃料洁净环保以及电池结构简单等特性。这使得直接甲醇燃料电池(DMFC)可能成为未来便携式电子产品应用的主流。如图以甲醇为燃料的新型电池是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)如图中的B极上的电极反应式为______。
(2)若用上述甲醇燃料电池做电源,用惰性电极电解100mL,5mol·L-1硫酸铜溶液,当阳极收集到3.36L(标准状况)气体时,消耗甲醇的质量为____g,此时可向电解后的溶液中加入_____使溶液复原。请写出电解硫酸铜溶液的电解反应化学方程式____。
(3)若用上述甲醇燃料电池做电源,用石墨做电极在一定条件下电解饱和食盐水制取NaOH。

①如图电解池的电极a接甲醇燃料电池的_____极( 填A或B) ,写出阳极的电极反应式:_____。假设电解时还产生一种黄绿色气体二氧氯(ClO2),写出阳极产生ClO2的电极反应式_________。
②电解一段时间,当阴极产生的气体体积为224 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R 是 6 种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)元素 X 在元素周期表中的位置是_____
(2)元素 M 组成的单质的电子式为_____
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_________________
(4)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_____
(5)元素Q、元素 Z 的含量影响钢铁性能,若钢样中元素 Z 以 FeZ 的形式存在,高温下在过量空气中反应生成ZO2和一种红棕色的氧化物,则反应的化学方程式是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是( )
①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3-二甲基戊烷 ④![]() 与C8H6互为同分异构体
与C8H6互为同分异构体
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
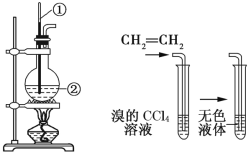
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
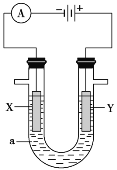
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为__________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_____________,检验该电极反应产物的方法是______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①Y电极的材料是_______________,主要的电极反应式为_____________________。
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为_______________________,电解池盛放的电镀液可以是__________________________(只要求填一种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com