
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解
【答案】B
【解析】
A.加入盐酸,次氯酸根离子在酸溶液中具有强氧化性氧化氯离子生成氯气,反应的离子方程式:ClO-+Cl-+2H+=Cl2↑+H2O,故A正确;
B.实验②0.2molL-1KI-淀粉溶液中滴入次氯酸钠溶液,发生的反应是碱性溶液中次氯酸钠氧化碘化钾生成碘单质,反应的离子方程式:ClO-+2I-+H2O=Cl-+I2+2OH-,故B错误;
C.在0.2mol/LFeSO4酸性溶液中滴加0.2mol/LNaClO溶液,Fe2+和ClO-发生氧化反应生成的Fe3+遇KSCN,使溶液显红色,即说明Fe2+还原性大于Cl-,故C正确;
D.NaClO溶液水解显碱性,AlCl3溶液水解显酸性,二者混合相互促进水解,生成Al(OH)3白色胶状沉淀,故D正确;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】ZnSO4 受热分解过程中各物质物质的量随温度变化关系如图所示(A、B为含硫的氧化物),下列说法正确的是( )

A.ZnO 属于金属晶体
B.SO3 和 SO2 互为同素异形体
C.物质 A、B 分别是 SO3、SO2
D.700℃~980℃时发生反应的化学方程式为:2ZnSO4![]() 2ZnO+2SO2↑+O2↑
2ZnO+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取乙烯的发生装置和验证乙烯性质的实验装置,反应原理为 CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
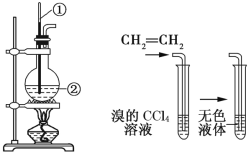
图1 图2
回答下列问题:
(1)图1中仪器①、②的名称分别为_______、_______。
(2)收集乙烯气体最好的方法是__________________。
(3)向溴的CCl4溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于_______(填反应类型),发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③甲苯 ④乙炔,其中:
(1)能衡量一个国家的石油化工生产水平的是____________(填序号,下同),该物质可用于一种常用塑料,其反应的化学方程式是_____________________________________________________。
(2)能用来制取梯恩梯(TNT)的是______________。
(3)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:

①甲中反应的化学方程式是_____________________________________________________ ,
②滴加饱和食盐水而不直接滴加水的原因是________________________________________,
③乙中硫酸铜溶液的作用是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
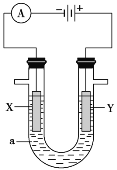
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为__________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_____________,检验该电极反应产物的方法是______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①Y电极的材料是_______________,主要的电极反应式为_____________________。
②溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为_______________________,电解池盛放的电镀液可以是__________________________(只要求填一种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列性质不能证明乙酸是弱电解质的是
A.0.1mol/L乙酸溶液的![]()
B.![]() 溶液的
溶液的![]()
C.将0.1mol/L乙酸溶液稀释100倍,pH变化<2
D.乙酸溶液的导电性比盐酸溶液的导电性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,将![]() 通入水中发生反应,转移的电子数为
通入水中发生反应,转移的电子数为![]()
B.常温常压下,![]() 与
与![]() 混合物含有的氧原子数为
混合物含有的氧原子数为![]()
C.将![]() 与过量
与过量![]() 反应转移的电子数为
反应转移的电子数为![]()
D.标准状况下,![]() 中所含电子数为
中所含电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com