
����Ŀ�����������л������ϩ ��2-���� �ۼױ� ����Ȳ�����У�
��1���ܺ���һ�����ҵ�ʯ�ͻ�������ˮƽ����____________(����ţ���ͬ���������ʿ�����һ�ֳ������ϣ��䷴Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
��2����������ȡ�ݶ��ݣ�TNT������______________��
��3��̼Ԫ�ص������ٷֺ�����ߵ���________��ʵ������ȡ�����ʵķ�Ӧװ�����£�

�ټ��з�Ӧ�Ļ�ѧ����ʽ��_____________________________________________________ ��
�ڵμӱ���ʳ��ˮ����ֱ�ӵμ�ˮ��ԭ����________________________________________��
����������ͭ��Һ��������______________________________________________________��
���𰸡��� nCH2=CH2![]()
![]() �� �� CaC2 +2H2O��Ca(OH)2 +HC��CH�� ������Ӧ���� ��ȥ��Ȳ�е��������������
�� �� CaC2 +2H2O��Ca(OH)2 +HC��CH�� ������Ӧ���� ��ȥ��Ȳ�е��������������
��������
��1������һ������ʯ�ͻ�������ˮƽ�ı�־Ϊ��ϩ���ʢ���ȷ����ϩ�к���̼̼˫������ͨ���Ӿ۷�Ӧ�õ��߷��ӻ��������Ӧ����ʽΪnCH2=CH2![]()
![]() ��
��
��2��TNTΪ�������ױ�����ȡ�������ױ����ױ���Ũ������Ũ���Ტ���ȵ������½��У��ʢ���ȷ��
��3������ʵ��װ�ã����������õ�ʯ��ʳ��ˮ�Ʊ���CaC2��2H2O��Ca(OH)2��C2H2������������������к�̼����ߵ�����Ȳ��
�ٵ�ʯ��H2O��Ӧ�Ʊ���Ȳ���䷴Ӧ����ʽΪCaC2��2H2O��Ca(OH)2��C2H2����
�ڵ�ʯ��ˮ��Ӧ���ң����ʵ���ҳ��ñ���ʳ��ˮ����ˮ��Ŀ���Ǽ�����Ӧ���ʣ�
����Ȳ�л���H2S���壬CuSO4��H2S=CuS����H2SO4���������ͭ��Ŀ���dz�ȥ��Ȳ�����H2S��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300��ʱ��������X������Y��0.16 mol����10 L�����ܱ������У�������Ӧ��X(g) +Y(g)![]() 2Z(g) ��H��0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�ش��������⣺
��1����Ӧ0~2 min Z��ƽ������v(Z)=_____________
��2�����жϸ÷�Ӧ�Ѿ��ﵽƽ��״̬����_____________
A������X������������Z�����ʵ�2��
B��������ѹǿ���ֲ���
C��������������ܶȱ��ֲ���
D�������ڸ������Ũ�ȱ��ֲ���
��3��Ҫ���������Ӧ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____________����дһ�֣���
��4���¶�Ϊ300��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��_______________
��5������ʼʱ��������г���X��Y��Z��0.20 mol����Ӧ����____����������������������Ӧ������У���ƽ��ʱZ���������������ƽ�����______������������������С��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������H2O2�����Ļ��ϼ�Ϊ��1�ۣ�������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڡ���������A��D�漰H2O2�ķ�Ӧ����д�հף�
A��Na2O2+2HCl===2NaCl+H2O2
B��Ag2O+H2O2===2Ag+O2+H2O
C��2H2O2===2H2O+O2
D��3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
��1��H2O2�����������Եķ�Ӧ��_________������ţ���
��2��H2O2�����������������ֻ�ԭ�Եķ�Ӧ��_________������ţ���
��3����ϡ�����У�KMnO4��H2O2�ܷ���������ԭ��Ӧ��
������Ӧ��H2O2��2e��===2H++O2��
��ԭ��Ӧ��MnO![]() +5e��+8H+===Mn2++4H2O
+5e��+8H+===Mn2++4H2O
д����������ԭ��Ӧ�����ӷ���ʽ��___________________��
��4����K2Cr2O7+14HCl===2KCl+3Cl2��+7H2O+2CrCl3�ķ�Ӧ�У���0.3 mol����ת��ʱ����Cl2�����Ϊ______����״��������������HCl�����ʵ���Ϊ____��
��5����ȥþ���л���������������ܽ⡢_______��������ѧ��Ӧ����ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и������ʣ������¸����밴Ҫ����д��Ӧ��ţ�
A.O2��O3 B.![]() C��
C��![]() C C.
C C.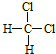 ��
��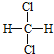 D.CH3CH2CH2CH3��
D.CH3CH2CH2CH3�� E.������� F.CH(CH3)3��C(CH3)4 G.C3H8��C10H22 H.CH2=CH2��CH3CH=CH2 I.H2��D2 J.C3H6��C5H10
E.������� F.CH(CH3)3��C(CH3)4 G.C3H8��C10H22 H.CH2=CH2��CH3CH=CH2 I.H2��D2 J.C3H6��C5H10
��1��___�黥Ϊͬλ�أ�
��2��___�������ʻ�Ϊͬ�������壻
��3��___�������ʻ�Ϊͬϵ�
��4��___���������ʻ�Ϊͬ���칹�壻
��5��___���е�������ͬһ���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�IJ�����������ͬ���칹�����
��CH3CH2CH2Br�ڼ�����Һ��ˮ�⡡�ڼױ��ڴ�����������Cl2���������ϵ�ȡ����Ӧ����2���ȶ�����NaOH�Ҵ���Һ���ȷ�Ӧ �� �ڴ����Ĵ�����������ȫ�ӳ� �������ϩ��
�ڴ����Ĵ�����������ȫ�ӳ� �������ϩ�� ��������ʵ�����Br2�����ӳɷ�Ӧ
��������ʵ�����Br2�����ӳɷ�Ӧ
A. �٢ڢ� B. �٢ڢ� C. �ڢۢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO��Ư��Һ����Ч�ɷ֣�ij�о�С��̽��NaClO��Һ�����ʣ����������ʵ�飺
װ��ͼ | �Լ�X | ʵ������ | |
| �� | 0.2molL-1���� | ��������ɫ���� |
�� | 0.2molL-1KI-������Һ | ��Һ���� | |
�� | 0.2molL-1FeSO4(H+)��KSCN�����Һ | ��Һ��� | |
�� | 0.2molL-1AlCl3��Һ | ������ɫ���� | |
�����жϲ���ȷ����
A.ʵ����з����ķ�Ӧ��ClO-+Cl-+2H+��Cl2��+H2O
B.ʵ����з����ķ�Ӧ��ClO-+2I-+2H+��Cl-+I2+H2O
C.ʵ����и�������������ǿ����ClO-��Fe3+
D.ʵ�����ClO-��Al3+��ٽ�ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����ͬ���칹����Ŀ�ж���ȷ���ǣ� ��
A. C5H10����6�ֵ�ϩ��ͬ���칹��B. 1-�������飨![]() ������4��һ�ȴ���
������4��һ�ȴ���
C. C6H14����5��ͬ���칹��D. CH2Cl2��������ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�1,2-���������ʵ���������£�
![]()
��֪������Ҫ����Ӧ���Ҵ���Ũ����Ĵ�������l40����ˮ�������ѡ�
���й������б����£�
�Ҵ� | 1,2-�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܽ��� | ������ˮ | ������ˮ | ������ˮ |
�е㣯�� | 78.5 | 132 | 34.6 |
�Իش��������⣺
��1���Ҵ���Ũ����l70�淢����Ӧ�Ļ�ѧ����ʽ��______________________��
��2���Ҵ���Ũ���ᷴӦװ���з��뼸Ƭ���Ƭ��Ŀ����_________________________��
��3����Ӧ�õ��Ļ�������к���SO2��CO2�����壬�������е�SO2�����ѡ�õ��Լ���_______________________________��
��4�����ղ����У�Ӧ�ʵ���������Һ���¶ȣ�����ҪĿ����______________��
��5��ʵ���Ƶõ�1,2-��������ֲ�Ʒ�к�������δ��Ӧ��Br2����������Ʒ���ѣ�ijͬѧ��һ���ᴿ���£�
��� | ʵ�鷽�� | ʵ��Ŀ�Ļ���� |
�� | ��ȥ�ֲ�Ʒ������δ��Ӧ��Br2��ʵ�鷽����_________________ | ��ȥ������ |
�� | ��ȥ�ֲ�Ʒ�е����ѵ�ʵ�鷽���ǽ���ʵ�����л���������________________________ | ��ȥ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��NO��NO2�ȵ��������ǿ�����Ⱦ�ﺬ�е��������β���账��������ŷš�
��1��N2O�Ĵ�����N2O�����������а��������ĸ���������ִ�����ʹN2O�ֽ⡣NH3��O2�ڼ��Ⱥʹ�������������N2O�Ļ�ѧ����ʽΪ___��
��2��NO��NO2�Ĵ������ѳ�ȥN2O������β������NaOH��Һ���գ���Ҫ��ӦΪ__��
�����д�ʩ�������β����NO��NO2ȥ���ʵ���____ (����ĸ����)
A����������Һ�����ķ�ʽ����β��
B���ӿ�ͨ��β��������
C������β�������ж���������NaOH��Һ
�����պ����Һ��Ũ�����ᾧ�����ˣ��õ�NaNO2���壬�þ����е���Ҫ������____(�ѧʽ)�����պ��ŷŵ�β���к����ϸߵĵ���������____(�ѧʽ)��
��3��NO���������ա���NaClO��Һ��������β���������β����NO��ȥ���ʡ�����������ͬ�� NO��ת������NaClO��Һ��ʼpH(��ϡ�������)�ı仯��ͼ��ʾ��
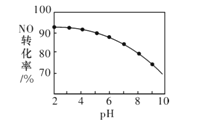
������NaClO����Һ�У�HC1O����NO����Cl��NO3-�������ӷ���ʽΪ3HClO+2NO+H2O=3C1-+2NO3-+5H+
��NaClO��Һ�ij�ʼpHԽС��NOת����Խ�ߣ���ԭ����_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com