
【题目】N2O、NO和NO2等氮氧化物是空气污染物含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为___。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为__。
①下列措施不能提高尾气中NO和NO2去除率的有____ (填字母代号)
A.采用气、液逆流的方式吸收尾气
B.加快通入尾气的速率
C.吸收尾气过程中定补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是____(填化学式),吸收后排放的尾气中含量较高的氮氧化物是____(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同, NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
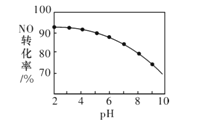
①在酸NaClO性溶液中,HC1O氧化NO生成Cl和NO3-,其离子方程式为3HClO+2NO+H2O=3C1-+2NO3-+5H+
②NaClO溶液的初始pH越小,NO转化率越高,其原因是_______。
【答案】2NH3+2O2![]() N2O+3H2O NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O B NaNO3 NO 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
N2O+3H2O NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O B NaNO3 NO 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
【解析】
依据氧化还原反应的规律结合元素守恒书写(1)、(2)问中的化学方程式;
(2)①从提高反应的转化率着手考虑;
②根据氢氧化钠吸收尾气后的产物分析作答;
(3)根据图像分析得出结论。
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)N2O的硝酸尾气中含NO2和NO,它们与NaOH溶液反应的离子方程式为:NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O;
①A. 采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,A项错误;
B. 加快通入尾气的速率,不能提高尾气中NO和NO2的去除率,B项正确;
C. 定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,C项错误;
故答案为:B;
②由反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+ NO3-+H2O可知,反应后得到NaNO2和NaNO3混合溶液,经浓缩、结晶、过滤得到NaNO2和NaNO3晶体,因此得到的NaNO2混有NaNO3;由反应可知,若NO和NO2的物质的量之比大于1:1,NO不能被吸收,因此,吸收后排放的尾气中含量较高的氮氧化物是NO;
(3)在相同条件下,ClO-在酸性条件下以HClO的形式存在,具有强氧化性,氧化剂的浓度越大,氧化能力越强,由反应2NO+3HClO+H2O=2NO3-+3Cl-+5H+可知,溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③甲苯 ④乙炔,其中:
(1)能衡量一个国家的石油化工生产水平的是____________(填序号,下同),该物质可用于一种常用塑料,其反应的化学方程式是_____________________________________________________。
(2)能用来制取梯恩梯(TNT)的是______________。
(3)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:

①甲中反应的化学方程式是_____________________________________________________ ,
②滴加饱和食盐水而不直接滴加水的原因是________________________________________,
③乙中硫酸铜溶液的作用是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
A. NH3 平面三角形 sp3杂化 B. CCl4 正四面体 sp3杂化
C. H2O V形 sp2杂化 D. CO32﹣ 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:

下列关于该化合物的说法正确的是 ( )
A. 分子式为C16H25O
B. 含有苯环结构
C. 该物质1mol一定条件下最多能与3mol氢气反应
D. 分子中含有一种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,将![]() 通入水中发生反应,转移的电子数为
通入水中发生反应,转移的电子数为![]()
B.常温常压下,![]() 与
与![]() 混合物含有的氧原子数为
混合物含有的氧原子数为![]()
C.将![]() 与过量
与过量![]() 反应转移的电子数为
反应转移的电子数为![]()
D.标准状况下,![]() 中所含电子数为
中所含电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com