
【题目】实验室制备1,2-二溴乙烷的实验流程如下:
![]()
已知:①主要副反应:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
②有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
溶解性 | 易溶于水 | 难溶于水 | 难溶于水 |
沸点/℃ | 78.5 | 132 | 34.6 |
试回答下列问题:
(1)乙醇与浓硫酸l70℃发生反应的化学方程式:______________________。
(2)乙醇与浓硫酸反应装置中放入几片碎瓷片,目的是_________________________。
(3)反应得到的混合气体中含有SO2、CO2等气体,检验其中的SO2气体可选用的试剂是_______________________________。
(4)吸收步骤中,应适当降低吸收液的温度,其主要目的是______________。
(5)实验制得的1,2-二溴乙烷粗产品中含有少量未反应的Br2和少量副产品乙醚,某同学进一步提纯如下:
序号 | 实验方案 | 实验目的或结论 |
① | 除去粗产品中少量未反应的Br2,实验方法是_________________ | 除去溴杂质 |
② | 除去粗产品中的乙醚的实验方法是将①实验后的有机混合物进行________________________ | 除去乙醚杂质 |
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 以避免混合液在受热时暴沸 品红溶液 避免溴单质大量挥发 用NaOH溶液洗涤,分液 蒸馏
CH2=CH2↑+H2O 以避免混合液在受热时暴沸 品红溶液 避免溴单质大量挥发 用NaOH溶液洗涤,分液 蒸馏
【解析】
(1)乙醇在浓硫酸催化作用下加热到l70℃会生成乙烯与水;
(2)碎瓷片可防止暴沸;
(3)二氧化硫可使品红溶液褪色;
(4)根据溴易挥发的特点考虑分析;
(5)氢氧化钠会与溴反应;结合已知的表格信息,根据沸点不同选择除杂方法。
(1)乙醇在浓硫酸催化作用下加热到l70℃会生成乙烯与水,其化学方程式为:CH3CH2OH![]() CH2=CH2↑+H2O,
CH2=CH2↑+H2O,
故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)乙醇与浓硫酸反应装置中,为防止混合液受热是发生暴沸,可放入几片碎瓷片,
故答案为:以避免混合液在受热时暴沸;
(3)检验是否存在二氧化硫,可使用品红溶液,
故答案为:品红溶液;
(4)因溴易挥发,为不影响产率,避免溴单质大量挥发,应适当降低吸收液的温度,
故答案为:为避免溴单质大量挥发;
(5)1,2-二溴乙烷粗产品中含有少量未反应的Br2,可用氢氧化钠溶液洗涤,再通过分液方法分离除去Br2;根据表格信息可知,乙醚沸点为34.6℃,而1,2-二溴乙烷的沸点为132℃,则可采用蒸馏法进行分离,
故答案为:用NaOH溶液洗涤,分液;蒸馏。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是__________。
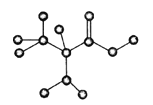
(2)下图是某有机物分子的简易模型,该有机物中含C、H、O、N四种元素。该有机物的分子式为______。
(3)有机物![]() 的键线式为________________;将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是_____________。
的键线式为________________;将其在催化剂存在的条件下完全氢化,所得烷烃的系统命名是_____________。
(4)苯和液溴反应的化学方程式________。苯酚和NaOH溶液反应的化学方程式__________。
(5)已知某有机物由碳、氢、氧三种元素组成,其相对分子质量为58,取5.8g该有机物在氧气中完全燃烧,将产物依次通过浓硫酸和碱石灰,两者分别增重5.4g和13.2g,回答:该有机物的分子式是_____。若该有机物可使溴水褪色,也能与钠反应,核磁共振氢谱显示该分子中存在四种化学环境不同的氢原子,则该有机物的结构简式可能是______________。
(6)四联苯![]() 的一氯代物有______种。
的一氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③甲苯 ④乙炔,其中:
(1)能衡量一个国家的石油化工生产水平的是____________(填序号,下同),该物质可用于一种常用塑料,其反应的化学方程式是_____________________________________________________。
(2)能用来制取梯恩梯(TNT)的是______________。
(3)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:

①甲中反应的化学方程式是_____________________________________________________ ,
②滴加饱和食盐水而不直接滴加水的原因是________________________________________,
③乙中硫酸铜溶液的作用是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列性质不能证明乙酸是弱电解质的是
A.0.1mol/L乙酸溶液的![]()
B.![]() 溶液的
溶液的![]()
C.将0.1mol/L乙酸溶液稀释100倍,pH变化<2
D.乙酸溶液的导电性比盐酸溶液的导电性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。

A. 方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B. 方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C. 方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D. 方案二中若用空气代替O2进行实验,则测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
A. NH3 平面三角形 sp3杂化 B. CCl4 正四面体 sp3杂化
C. H2O V形 sp2杂化 D. CO32﹣ 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:

下列关于该化合物的说法正确的是 ( )
A. 分子式为C16H25O
B. 含有苯环结构
C. 该物质1mol一定条件下最多能与3mol氢气反应
D. 分子中含有一种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或描述中,不正确的有
①F-的结构示意图:![]()
②氢氧根的电子式:![]()
③HClO的结构式:H—Cl—O
④SO3的水溶液能导电,说明SO3是电解质
⑤NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
⑥同素异形体间的转化和同位素间的转化都是化学变化
A. 1项 B. 2项 C. 5项 D. 6项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com